Forças intermoleculares: o que são e o que causam?
O prefixo inter, das forças intermoleculares, quer dizer entre. Levando ao pé da letra, seriam forças entre moléculas. Mas, o que fazem? Ondem vivem? O que comem?

Acessibilidade
As forças intermoleculares, ou interações intermoleculares, são a forma com que as moléculas interagem entre si. São elas que mantêm unidas as moléculas de uma substância, fazendo com que sejam sólidas, líquidas ou gasosas!
Assim, as interações intermoleculares são determinantes das propriedades das substâncias. Dependendo de como as moléculas interagem, as substâncias podem ter diferentes estados físicos, solubilidade, ponto de fusão e ebulição, densidade e até a tensão superficial dos líquidos.
Por isso, é muito importante entender como as moléculas interagem! Além disso, é um assunto muito frequente nos vestibulares e que permite entender diversos outros conteúdos da química.
NAVEGUE PELOS CONTEÚDOS
Tipos de forças intermoleculares
As forças intermoleculares são chamadas também de Forças de Van der Waals, pois foi ele o cientista que primeiro teorizou e descreveu essas interações, sejam elas dipolo-dipolo, dipolo induzido ou interações de hidrogênio.
Por isso, precisamos sempre levar todas essas forças em consideração. Assim, faz-se a soma de todas elas, e o sentido do deslocamento ou deformação terá o mesmo sentido da chamada força resultante.
As interações intermoleculares dependem muito da polaridade das moléculas. Uma molécula é dita polar quando possui dois polos (dipolo): uma região com maior concentração de elétrons, e outra defasada em elétrons. Isso é determinado pela polaridade das ligações (eletronegatividade dos átomos) e pela geometria da molécula.
Polaridade das moléculas
A imagem abaixo mostra exatamente isso: a concentração de elétrons nas moléculas. As regiões mais vermelhas têm maior concentração de elétrons (mais negativas), e as regiões tendendo pro azul, estão mais defasadas em elétrons.
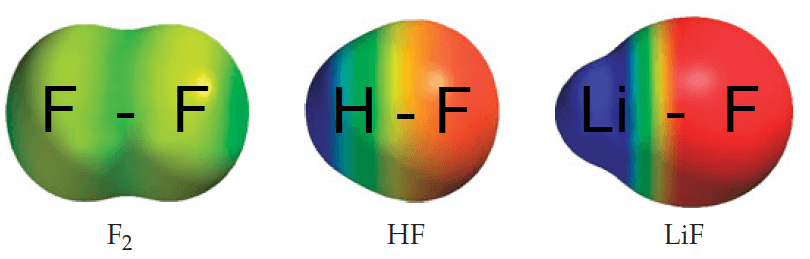
Assim, vemos que no HF e no LiF, existem dois polos: um negativo (vermelho, com mais elétrons) e um positivo (azul, com poucos elétrons). Por isso, essas moléculas são polares. A molécula de F2 é apolar, porque os elétrons estão igualmente distribuídos, em uma cor mais uniforme.
Forças de London: molécula apolar x molécula apolar
Também chamadas de interações do tipo dipolo induzido-dipolo induzido, elas acontecem entre duas moléculas apolares.
Como não temos polos permanentes, as interações eletrostáticas são muito fracas, e os dipolos aparecem apenas momentaneamente, induzidos por perturbações do meio.
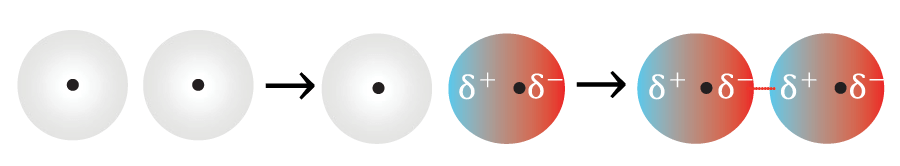
No início, temos duas moléculas apolares. Por uma perturbação, uma delas se polariza; por indução, a outra se polariza também e surge um dipolo instantâneo. Assim, elas interagem por forças dipolo induzido-dipolo induzido. Essas são as interações intermoleculares mais fracas.
Forças dipolo-dipolo: molécula polar x molécula polar
Chamadas também de dipolo permanente-dipolo permanente, essas forças são muito mais fortes do que as anteriores. Elas acontecem entre as moléculas polares: a parte mais negativa é atraída pela parte mais positiva. A interação está representada pela linha pontilhada:

Interações de hidrogênio
São as forças intermoleculares mais importantes! Elas também são interações do tipo dipolo-dipolo. As ligações de hidrogênio acontecem somente em moléculas polares, mas que possuam átomos muito eletronegativos - F, O ou N -, ligados diretamente ao Hidrogênio.
Já foram chamadas de pontes de hidrogênio, mas hoje a nomenclatura mais usual é ligações de hidrogênio.
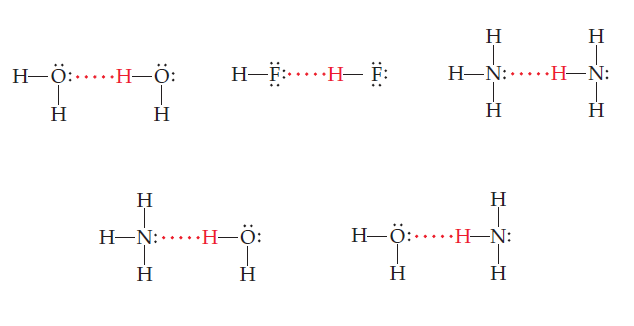
Abaixo estão as principais moléculas que fazem ligações de hidrogênio, representadas pela linha pontilhada. Estão representadas a água (H2O, ácido fluorídrico (HF), e amônia (NH3).
O exemplo mais comum disso é a interação que acontece com as moléculas de água. Como o oxigênio (em vermelho) é o elemento mais eletronegativo, ele vai atrair os elétrons em sua direção, deixando os hidrogênios (em branco) deficientes em elétrons. Assim, os H parcialmente positivos interagem com os oxigênios das moléculas vizinhas, que são parcialmente negativos.
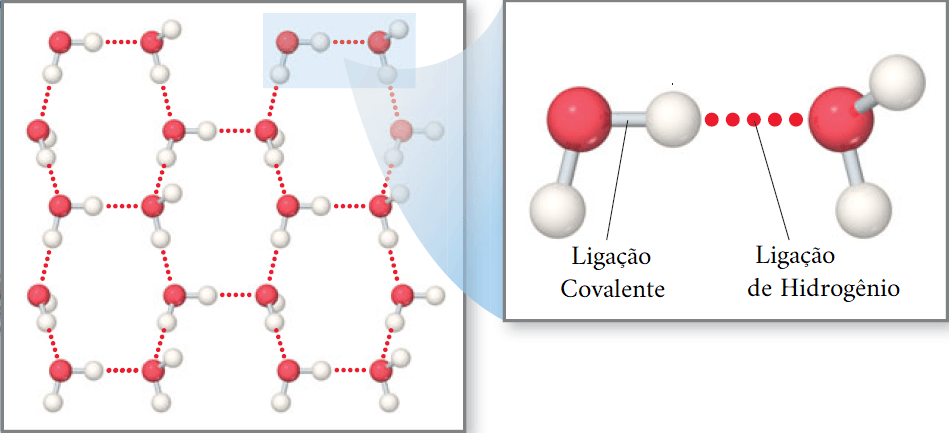
Como essas interações são muito fortes, são elas que mantém a água líquida.
Interações íon-dipolo
Geralmente estudada junto com as forças intermoleculares, as interações íon-dipolo, na verdade, são interações entre um íon e uma molécula e não entre duas moléculas!
Como os íons possuem carga, essas interações são as mais fortes entre todas as já citadas. É por causa dessas interações que os sais são capazes de se solubilizar.
Por exemplo, o NaCl, cloreto de sódio, em água, se dissocia, produzindo íons Cl- e Na+. Como eles têm carga, eles atraem os polos da molécula de água. Veja a imagem:
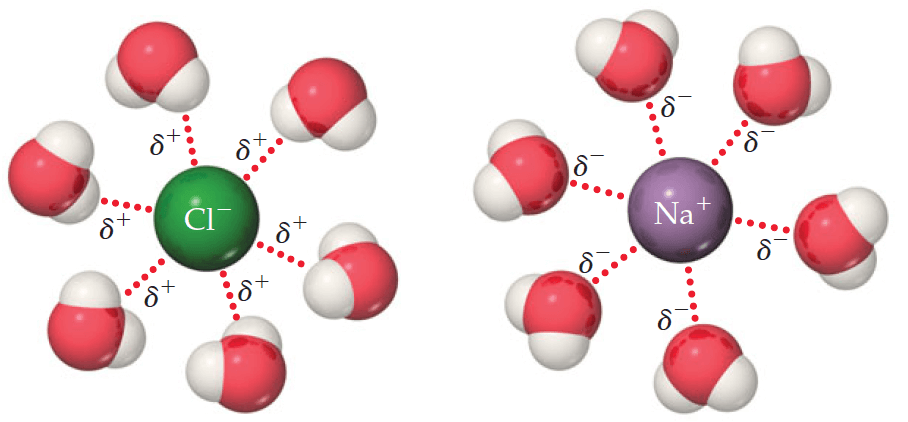
Assim, perceba que a parte positiva da molécula de água (hidrogênios, em branco) são atraídas pela carga negativa do ânion (Cl-). A parte negativa da molécula de água (oxigênio, em vermelho), é atraída pela carga positiva do cátion (Na+). Esse é o processo de solvatação dos íons.
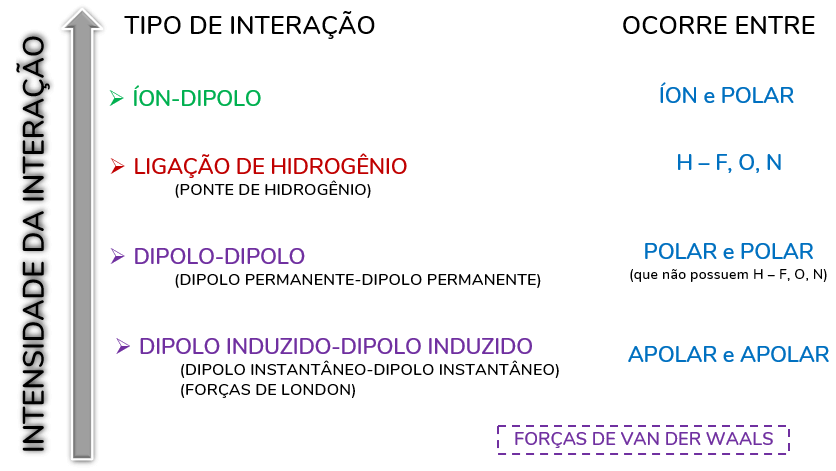
Intensidade das interações
É importante saber a intensidade das interações entre as espécies químicas, pois elas são determinantes das propriedades das substâncias. Veja abaixo
Implicações das forças intermoleculares
As interações intermoleculares são responsáveis por inúmeras propriedades das substâncias nas CNTP, como estado físico, solubilidade nos meios, volatilidade, densidade, temperatura de ebulição… Então, é importantíssimo saber como funcionam e quais as consequências delas
nessas propriedades.
Estado físico: interações intermoleculares fortes resultam em estados físicos condensados, porque as moléculas estão muito unidas. Sólidos têm interações mais fortes que líquidos, que por sua vez têm interações mais fortes que os gases, nos quais elas são praticamente inexistentes.

Densidade: em geral, quanto mais fortes as interações, maior a densidade da fase. Sólidos são mais densos que líquidos, que são mais densos que gases. Exceto para a água.
Temperatura de ebulição: quanto mais as moléculas do líquido interagem entre si, mais energia é necessário fornecer para que as interações sejam enfraquecidas e haja a mudança de fase (maior temperatura).
Volatilidade: quanto mais fracas as interações intermoleculares, mais volátil é a substância. (mas atenção, essa propriedade também depende do peso molecular).
Solubilidade nos meios: polar interage com polar e apolar interage com apolar. Por isso óleo não se mistura com água, por exemplo.
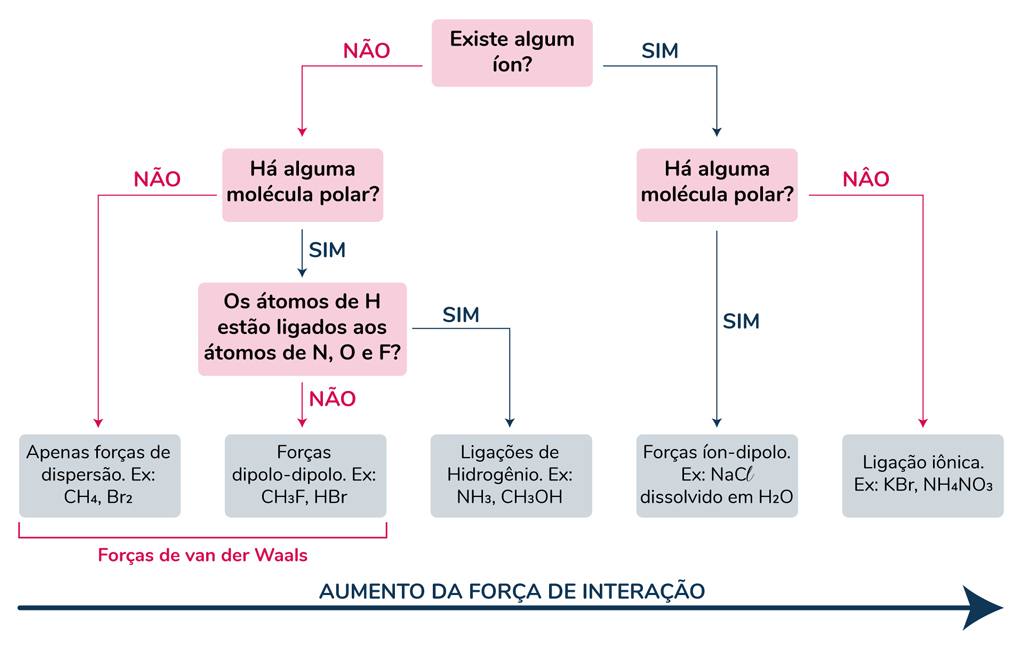
Resumo de forças intermoleculares
Para entender melhor as forças intermoleculares, confira abaixo um fluxograma que não vai deixar você erra nos vestibulares!
Quer saber mais sobre esse e outros conteúdos, além de ter acesso às melhores videoaulas para se preparar para os vestibulares e Enem? A plataforma Aprova Total tem tudo isso e muito mais!




