Geometria molecular: definição e exemplos
A geometria molecular é a forma com que cada molécula se arranja no espaço. Confira mais definições e exemplos!

Acessibilidade
A geometria molecular é a forma com que cada molécula se arranja no espaço. As moléculas não são planas, mas têm forma e volume!
A geometria de cada molécula depende do número de ligações que o átomo central faz. Em resumo, o átomo central é aquele que faz o maior número de ligações em uma molécula.
Antes de mais nada, para descobrirmos a geometria de uma molécula, precisamos conhecer a Teoria da Repulsão Eletrônica da Camada de Valência (em inglês, Valence Shell Electron Pair Repulsion Theory, VSEPR). Parece difícil, mas não é!
A VSEPR diz que todos os elétrons da camada de valência repelem uns aos outros. Essa repulsão acontece porque todos eles têm carga negativa, e dois corpos não ocupam o mesmo lugar no espaço. Consequentemente, cada nuvem eletrônica (a região do espaço onde está cada par de elétrons) vai estar o mais longe possível uma da outra, em torno do átomo central.
A nuvem eletrônica é a região do espaço ocupada por um par de elétrons. Pode ser um par isolado ou uma ligação química.
Por exemplo, sabemos que a molécula de amônia (NH3) tem 4 nuvens eletrônicas: 3 ligações químicas N-H e um par isolado sobre o átomo de nitrogênio. Em seguida, na esquerda, representamos as 4 nuvens eletrônicas da amônia:
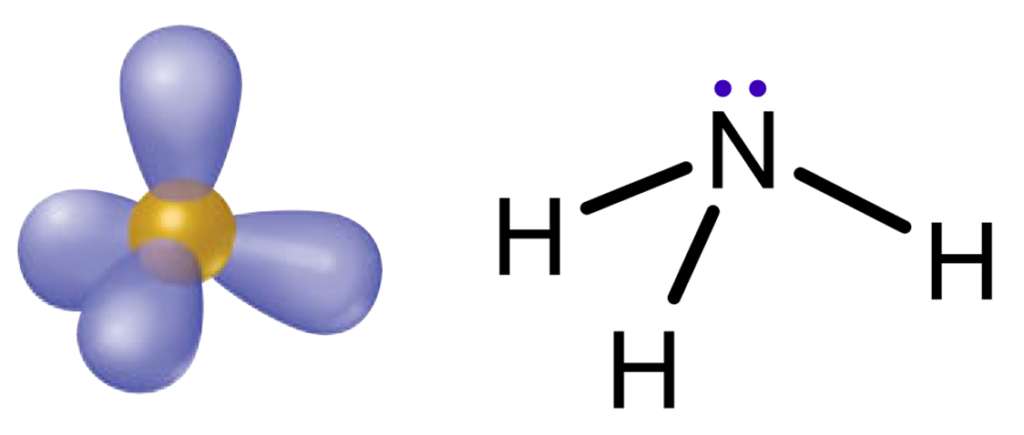
Note que o par eletrônico também ocupa lugar no espaço! Por isso a molécula de amônia não é plana, e sim, tridimensional. Assim, essa organização espacial é a que permite maior distância entre todas as nuvens eletrônicas, sejam ligações químicas ou pares isolados.
NAVEGUE PELOS CONTEÚDOS
Tipos de geometria molecular
A geometria da molécula depende do número de nuvens eletrônicas ao redor do átomo central. Independente se são pares isolados ou ligações químicas. Por isso, vamos analisar as geometrias de acordo com o número de átomos na molécula, sempre relacionando com as nuvens eletrônicas.
Geometria linear
A geometria mais simples é a linear. Dessa forma, podemos encontrar geometrias lineares em moléculas com 2 ou 3 átomos.
Quando as moléculas só têm dois átomos, é impossível que a geometria seja diferente! Não existe átomo central, então os dois átomos só podem estar em linha reta um do outro.
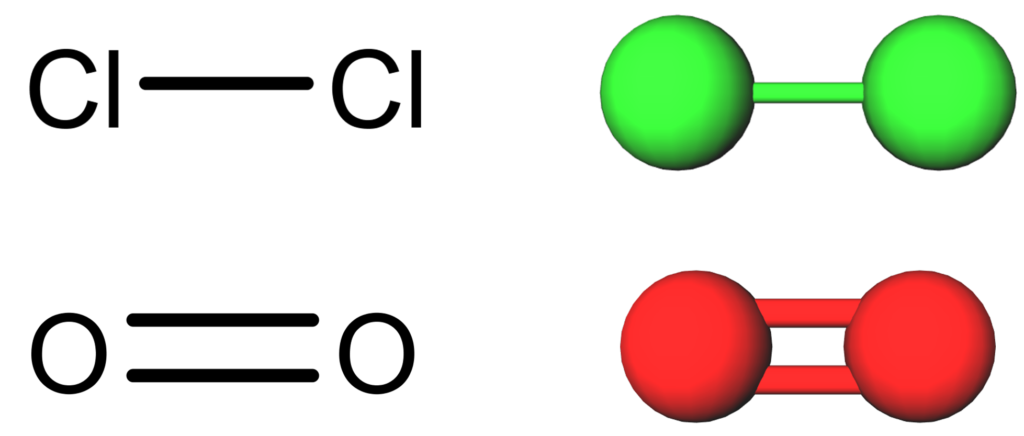
Quando a molécula é feita de três átomos, ela terá geometria linear se o átomo central não tiver nenhum par de elétrons não ligante. Assim, a molécula só vai ter duas nuvens eletrônicas e a maior distância possível que elas podem ficar uma da outra é em linha reta.
Observe a geometria molecular do CO2. Nesse caso, temos três átomos e nenhum par isolado.
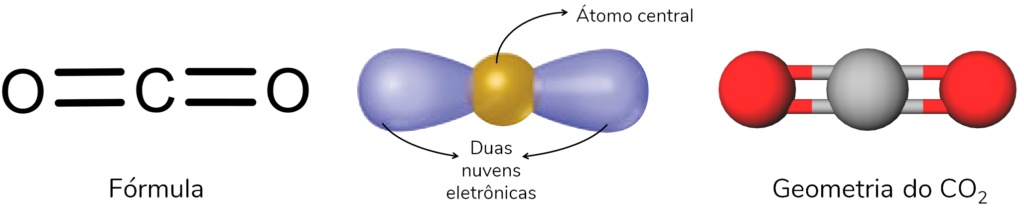
Nessa geometria, por exemplo, o ângulo entre as ligações é de exatamente 180°.
Geometria angular
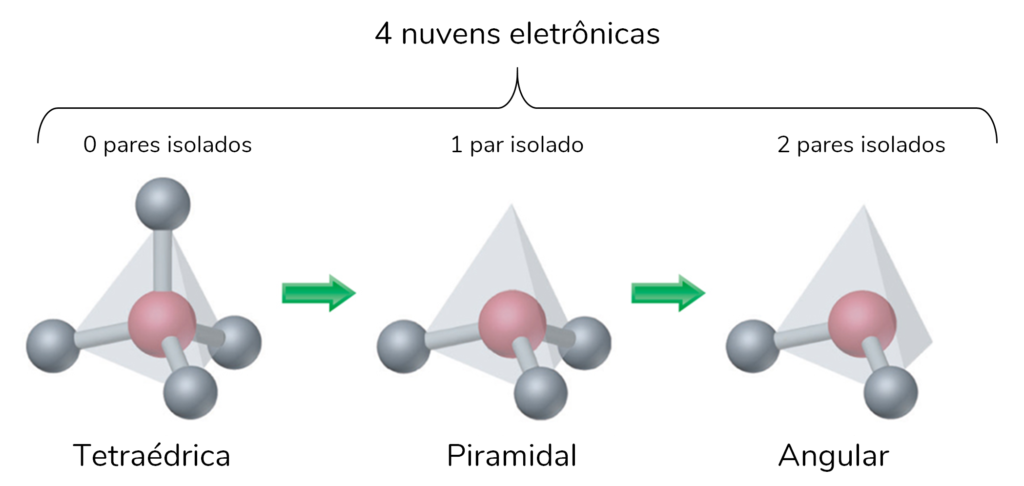
Encontramos geometria angular somente nas moléculas que possuem 2 ligantes no átomo central. Então, quando ele possui pelo menos um par isolado, a geometria será angular.
Por exemplo, o SO2 tem o enxofre como átomo central. Ele tem três nuvens eletrônicas: duas ligações químicas S-O, e um par isolado. Por isso, tem geometria angular. Observe a geometria molecular do SO2:
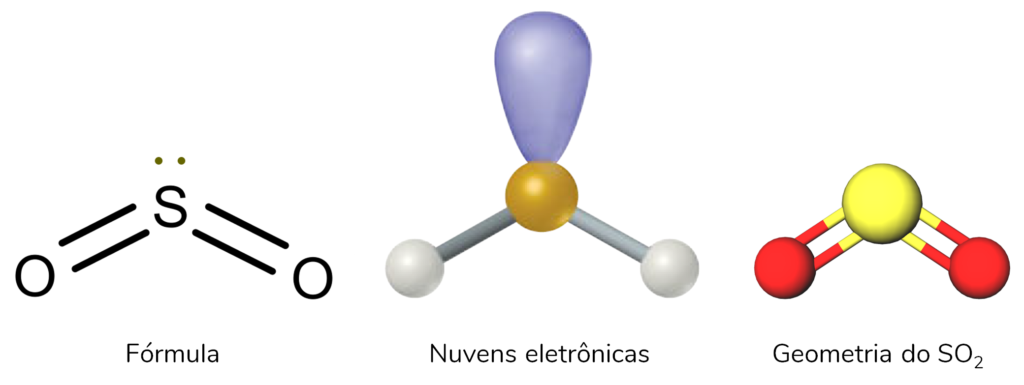
A geometria molecular do H2O (água) também é angular. Nela, o átomo central é o Oxigênio, que tem dois pares isolados. As 4 nuvens eletrônicas são: duas ligações químicas e dois pares isolados. Por isso, elas se afastam o máximo possível, e a estrutura fica angular.
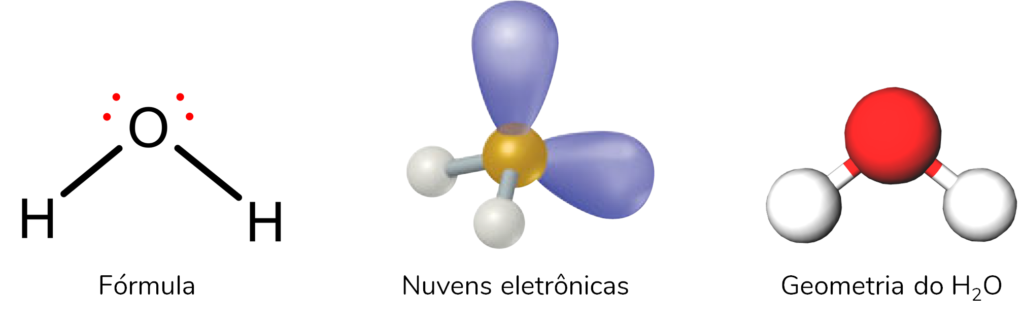
Assim, nessas moléculas, os ângulos entre as ligações químicas são de 104,9°.
Geometria trigonal plana
Como podemos ver pelo nome, essa estrutura é inegavelmente plana. Somente moléculas com três ligações no átomo central podem ter essa geometria. É o caso, portanto, do BF3, onde o átomo central é o Boro.
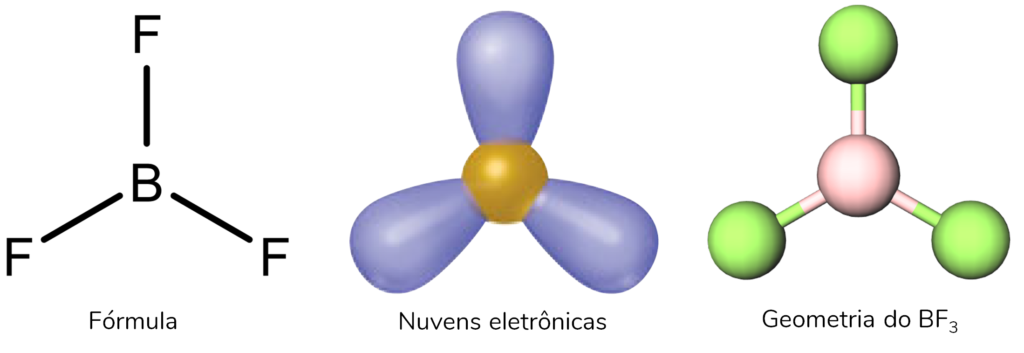
Dessa maneira, nesse caso, não pode existir nenhum par isolado! Se uma das nuvens fosse de um par isolado, e não de uma ligação química, a geometria seria angular, como é o caso do SO2.
Nessa geometria, os ângulos de ligação são de 120°.
Geometria piramidal
A geometria piramidal ou pirâmide trigonal ocorre com moléculas que tenham três ligantes no átomo central. Mas, ele precisa ter também um par isolado.
Esse é exatamente o caso da geometria molecular da amônia (NH3). Ela faz 3 ligações N-H e tem um par de elétrons não ligante. Por isso, possui 4 nuvens eletrônicas, e a geometria é piramidal.
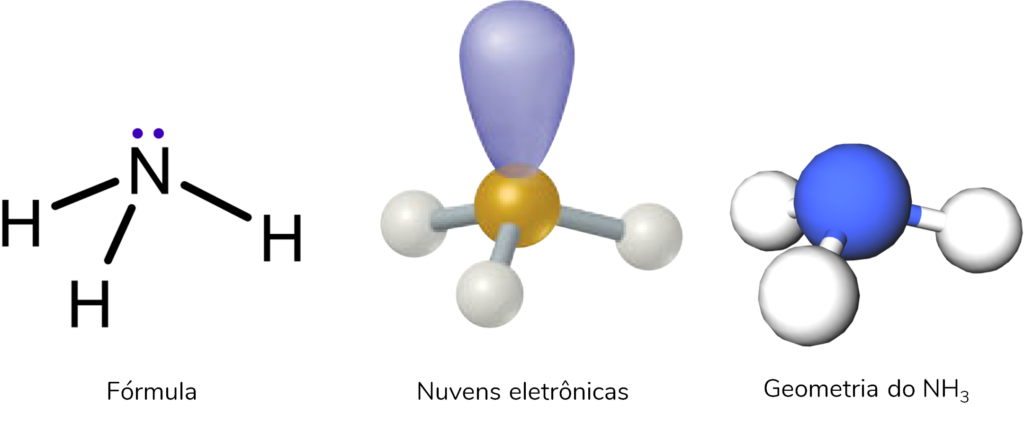
Nessa geometria, os ângulos de ligação entre os H são de 107°.
Geometria molecular tetraédrica
Encontramos moléculas com essas geometria quando há 4 ligantes no átomo central. Assim, essas estruturas também têm 4 nuvens eletrônicas no átomo central, que elas ser pares isolados ou ligações químicas.
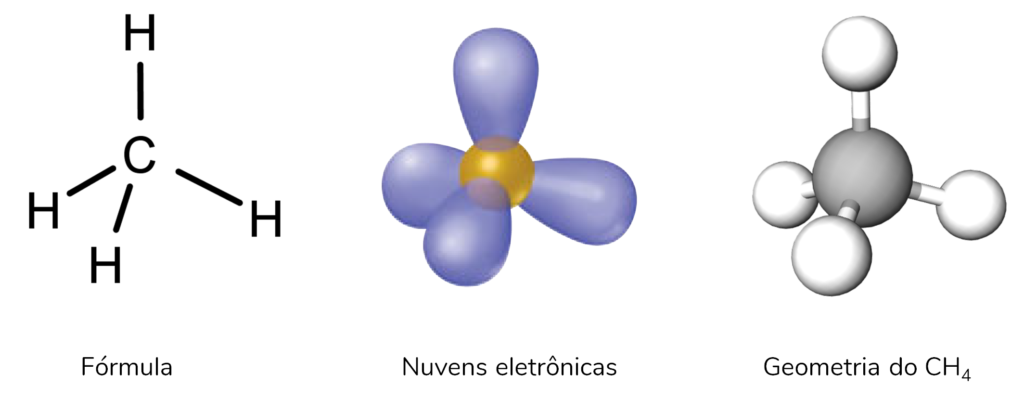
No entanto, perceba que o átomo central não tem nenhum par isolado! Se ele tivesse um par isolado no lugar de uma ligação, a geometria seria piramidal (como NH3). Do mesmo modo, se tivesse dois pares isolados, teria geometria angular (como H2O).
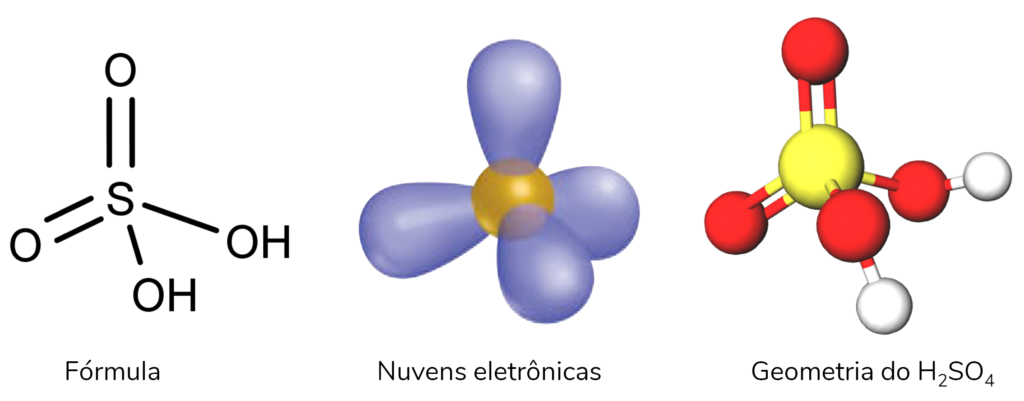
Podemos citar como exemplo de geometria tetraédrica o H2SO4. Assim como o CH4, ele tem 4 ligantes no átomo central. A molécula como um todo tem 7 átomos, mas só 4 estão ligados ao S. Portanto, só temos 4 nuvens eletrônicas ao redor dele, e por isso é uma molécula tetraédrica.
Os ângulos entre as ligações das moléculas com geometria tetraédrica são de 109,5°.
Geometria bipirâmide trigonal
Até agora, as geometrias que vimos eram de átomos que seguiam a regra do octeto. No entanto, existem elementos que podem expandir a sua camada de valência para formar moléculas a partir da segunda linha da tabela periódica.
Encontramos moléculas com geometria molecular bipirâmide trigonal quando existem 5 ligantes no átomo central, como é o caso do PCl5.
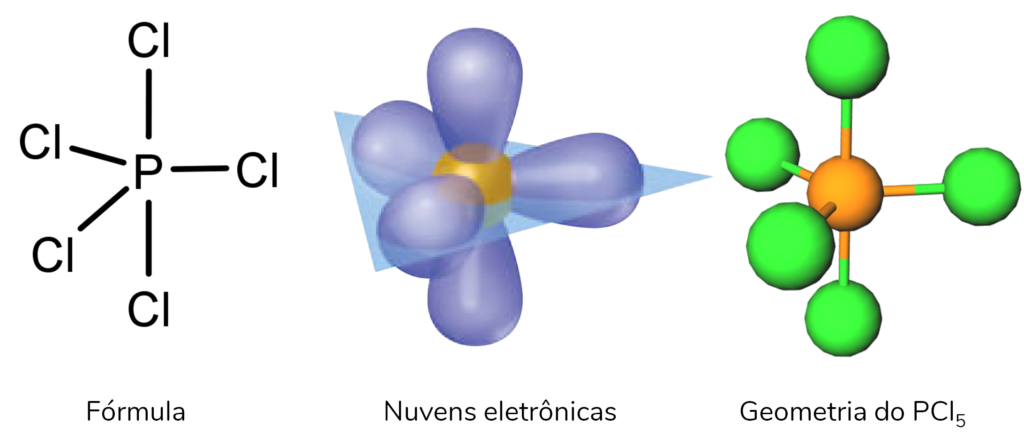
A partir dessa geometria com 5 nuvens eletrônicas, podem existir outras geometrias moleculares menos comuns, representadas na imagem abaixo.
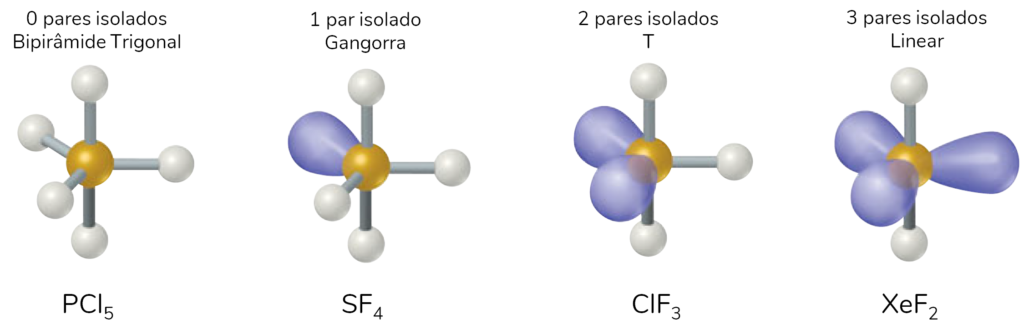
Geometria molecular octaédrica
Assim como a anterior, esta geometria também só acontece com elementos que podem expandir sua camada. Nesse caso, encontramos 6 nuvens eletrônicas ao redor do átomo central.
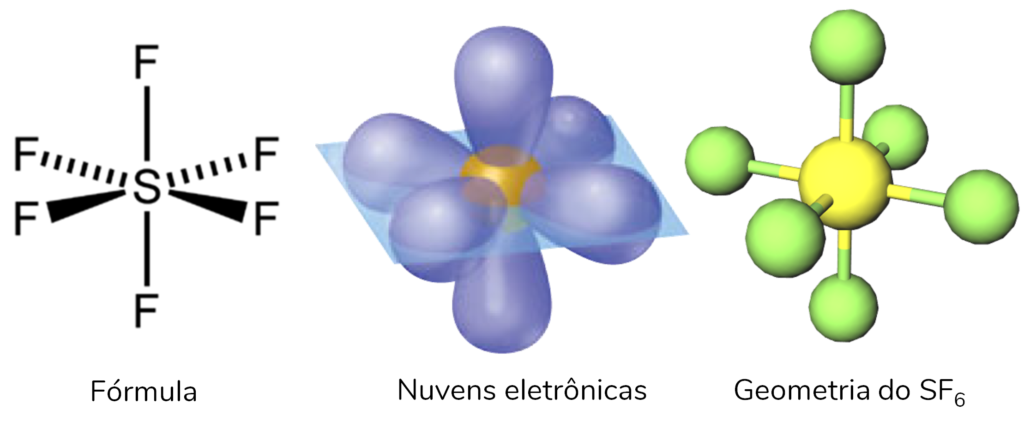
Nesse caso, os ângulos entre todas as ligações são de 90°.
Outras geometrias derivadas da octaédrica são a Pirâmide Quadrada e o Quadrado Planar. Em todos os casos, há 6 nuvens eletrônicas, mas pode ser que nem todas elas sejam de ligações químicas.
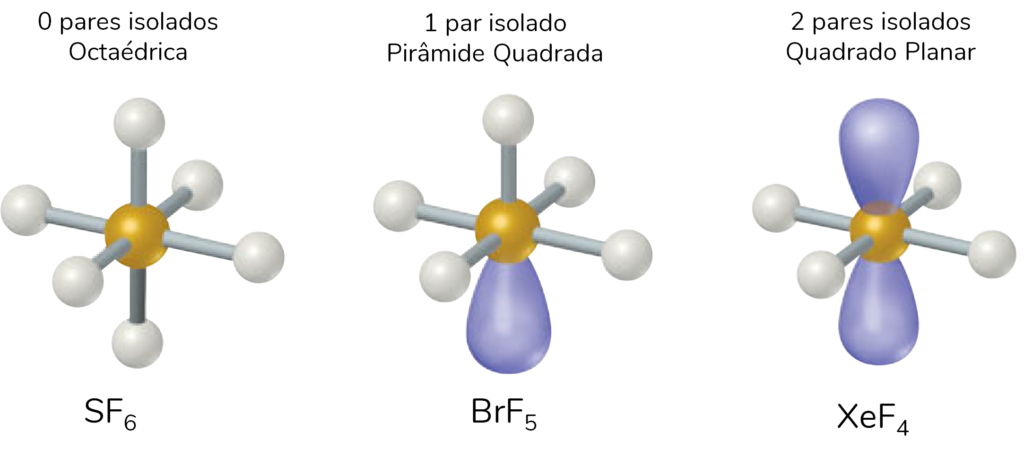
Para se preparar para o Enem ou vestibulares, conte com a plataforma Aprova Total, que oferece os melhores conteúdos e videoaulas. Conheça os cursos Extensivo Enem e Super Med!