Estequiometria: reagente limitante e em excesso
Nas reações químicas da vida real, por questões de deslocamento de equilíbrio, um dos reagentes encontra-se em um excesso estequiométrico. Por isso, é importante saber calcular a quantidade de produto formado nos casos onde temos um reagente limitante

Acessibilidade
Importante conteúdo de química para o Enem e vestibulares, a estequiometria estuda as relações de massa, mol, partículas e volume entre reagentes e produtos nas reações químicas. Como as reações químicas acontecem em proporções definidas, é fácil trabalhar com o cálculo estequiométrico normal, no qual as condições reacionais são ideais.
No entanto quando estamos trabalhando com reações químicas na prática, por questões de deslocamento de equilíbrio (aumento do rendimento da reação), um dos reagentes da reação precisa estar em excesso estequiométrico.
O reagente em excesso é aquele que está em uma quantidade estequiométrica superior à dos demais reagentes.
Ou seja, ele é chamado de reagente em excesso porque não vai ser inteiramente consumido na reação. Isso porque os demais reagentes não existem na reação em quantidades suficientes para consumi-lo.
Em contrapartida, o reagente limitante é aquele que está em proporção estequiométrica insuficiente. Ele é o reagente que será inteiramente consumido se o rendimento da reação for máximo. O reagente limitante é o componente que dita o fim da reação química, uma vez que quando um dos reagentes acaba, não há mais como a reação química ocorrer.
NAVEGUE PELOS CONTEÚDOS
Reagentes limitantes e em excesso nas reações
Imagine uma equação química de formação de um sanduíche:

Na reação acima, os reagentes estão nas proporções estequiométricas ideais, e formaremos exatamente um sanduíche para as quantidades de pão e queijo que temos.
O que acontece, no entanto, se tivermos um excesso de pão?
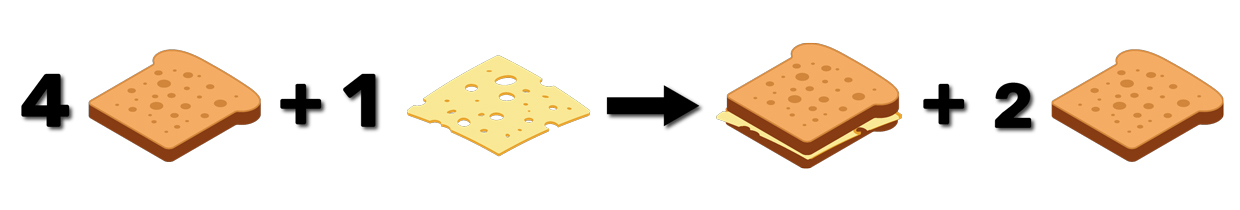
Nesse caso, temos quatro fatias de pão, um queijo – o que é suficiente para formarmos exatamente um sanduíche - e temos duas fatias de pão sobrando. Assim, o pão é o reagente em excesso.
Percebeu que não importa a quantidade de pão, pois, se só tivermos um queijo, só poderemos formar um sanduíche?
É exatamente por isso que, neste caso, o queijo é o reagente limitante: a quantidade de sanduíches formados só depende dele.
Assim, existem duas coisas que precisamos lembrar para o cálculo com reagentes em excesso e limitantes:
1. A quantidade de produto formada só depende da quantidade do reagente limitante.
2. O reagente em excesso não é inteiramente consumido na reação.
Se pararmos para pensar, essas duas coisas são bem claras: se o queijo foi inteiramente consumido para a formação de um sanduíche, com o que a sobra de pão vai formar novos sanduíches?
Agora, vamos finalmente aplicar esses conceitos às reações químicas.
Estequiometria passo a passo
Para entendermos a estequiometria, precisamos, antes de tudo, interpretar o que a questão está pedindo.
De maneira geral, podemos seguir estes passos:
1. Escreva a equação química balanceada.
2. Identifique as proporções entre reagentes e produtos.
3. Converta as unidades para mol, massa ou volume, conforme pede a questão.
4. Faça uma regra de três com as quantidades estequiométricas ideais dos reagentes, e então compare as quantidades fornecidas com a quantidade estequiométrica, determinando os reagentes limitante e em excesso.
5. Monte uma regra de três com as informações necessárias, onde a incógnita é o que a questão está pedindo.
Cálculo com reagente limitante e em excesso
Imagine a reação de oxidação do metal cobre exposto ao ar, formando óxido de cobre:
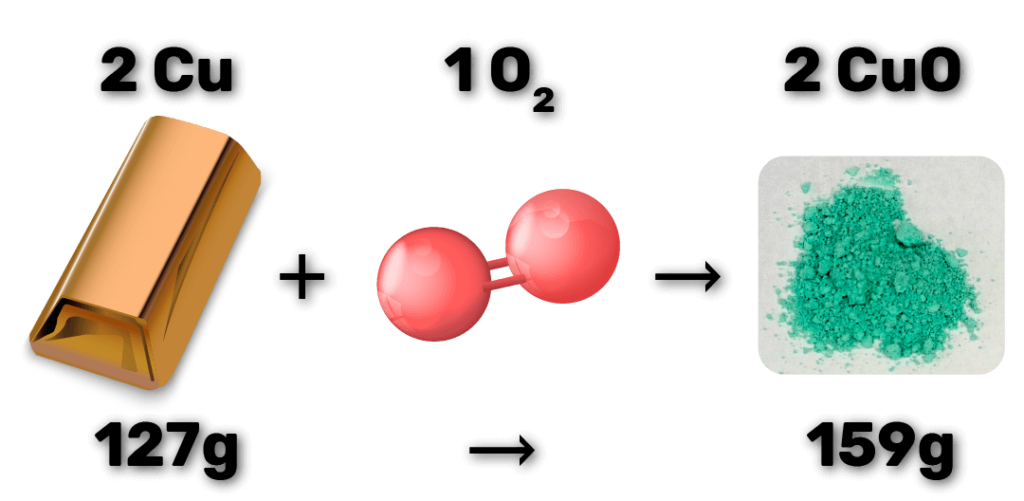
Nesse caso, a barra de cobre vai oxidar pela reação com oxigênio. Na reação acima, os reagentes estão nas proporções estequiométricas ideais, e o rendimento da reação é máximo para as quantidades de cada um dos reagentes.
O que acontece, no entanto, se a barra de cobre não estiver em contato com o oxigênio do ar? Ou seja, e se retirarmos todo o oxigênio da reação?
É isso mesmo: o cobre não oxida! Porém, continuamos com 127 g de cobre, porque o cobre não foi consumido.
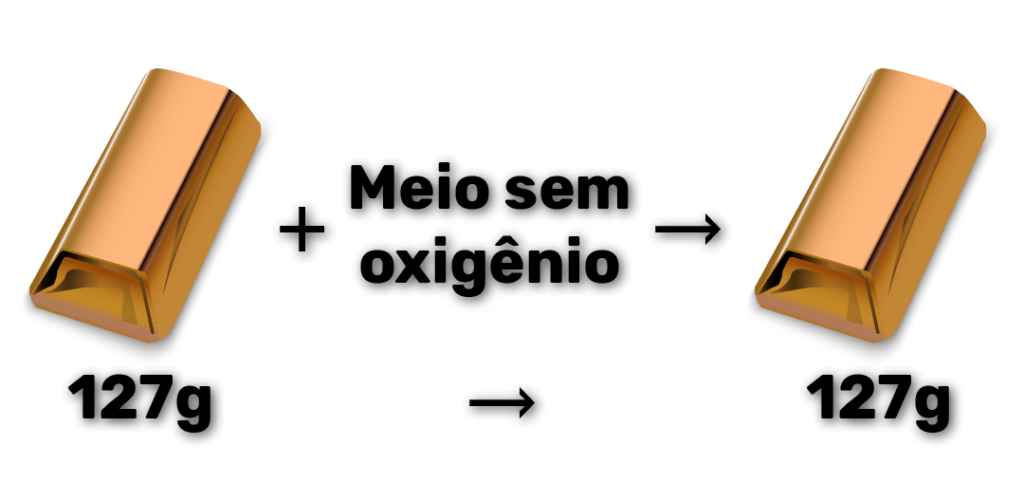
Assim, nessa reação de oxidação do cobre em meio sem oxigênio, o cobre é o reagente em excesso. Isso porque temos muito cobre para pouco oxigênio.
Caso 1: Determinação do reagente limitante
Em uma reação de oxidação do cobre metálico, tem-se 12 g do metal e 5 g de oxigênio. Qual dos dois é o reagente limitante e qual está em excesso?
2 Cu + O2 → 2 CuO
Primeiramente, precisamos saber quais as quantidades estequiométricas ideais em massa entre os reagentes. Dado o balanceamento acima, descobrimos que 127 g de Cu (Cu = 63,5 g/mol) reagem com 32 g de O2 (O = 16 g/mol) para formar 159 g de CuO (CuO = 79,5 g/mol).
Com essas informações, podemos fazer uma regra de três com um dos reagentes para descobrir a quantidade necessária do outro, nas proporções estequiométricas ideais.
127 g de Cu ----------- 32 g de O2
12 g de Cu ---------- x g de O2
x = 3,0 g de O2
Por esse cálculo, percebemos que 12,0 g de cobre reagem com 3,0 g de oxigênio, porém, temos 5,0 g de oxigênio. Assim, sabemos que o Oxigênio está em excesso, pois 2 g dele permanecem sem reagir. Como o oxigênio está em excesso, então o cobre é o reagente limitante.
Outra maneira de chegar à mesma conclusão seria utilizar a quantidade de cobre como incógnita, descobrindo quantos gramas de Cu serão necessários para reagir com 5 g de O2:
127 g de Cu ----------- 32 g de O2
xg de Cu ---------- 5 g de O2
x = 19,8 g de Cu
Desta maneira, sabemos que 5 g de O2 precisam de quase 20 g de Cu – mas só temos 12 g. Por isso, o cobre é o reagente limitante.
Caso 2: Cálculo estequiométrico com reagentes limitantes
Em uma reação de oxidação do cobre metálico, tem-se 12 g do metal e 5 g de oxigênio. Qual a quantidade de CuO formada?
2 Cu + O2 → 2 CuO
Lembre que a quantidade de produto formada só depende do reagente limitante - pois é ele quem vai acabar primeiro, e o reagente em excesso não tem com quem reagir.
No exemplo anterior, descobrimos que o cobre é o reagente limitante. Por isso, utilizamos a quantidade de massa de cobre para os cálculos, e não a quantidade de oxigênio.
O exercício quer saber a quantidade de produto, então, fazemos a regra de três com a proporção entre reagente limitante e produto formado.
127 g de Cu ---------- 159 g de CuO
12 g de Cu ---------- x g de CuO
x = 15 g de CuO
Assim, a quantidade de produto formada é de 15 g.
📖 Quer saber mais sobre esse e outros conteúdos, além de ter acesso às melhores videoaulas para se preparar para os vestibulares e Enem? A plataforma Aprova Total tem tudo isso e muito mais!