Isomeria: o que é, tipos e exemplos
A isomeria é um fenômeno muito importante estudado na química orgânica. Ela é dividida em dois grandes grupos: isomeria plana e isomeria espacial. Confira aqui tudo o que precisa saber sobre definição, tipos e exemplos

Acessibilidade
A isomeria é um fenômeno estudado dentro da química orgânica. Seu conceito é simples: ela ocorre entre compostos que possuem a mesma fórmula molecular, mas não são a mesma molécula. Ela pode ser divida em dois grandes grupos: isomeria plana e isomeria espacial.
Quer saber mais sobre esse fenômeno? Neste post, falaremos sobre os principais tipos de isomeria, como identificá-los e também sobre suas principais propriedades e exemplos. Vamos lá?
NAVEGUE PELOS CONTEÚDOS
O que é isomeria?
A palavra isomeria tem origem do grego: isos = igual e meros = partes. Ela é uma característica presente em certas moléculas que, apesar de possuírem a mesma fórmula molecular, possuem propriedades ou estruturas diferentes.
Para entendermos melhor esse conceito, vejamos, por exemplo, o composto C2H6O. Com a informação da fórmula molecular podemos montar duas estruturas diferentes:
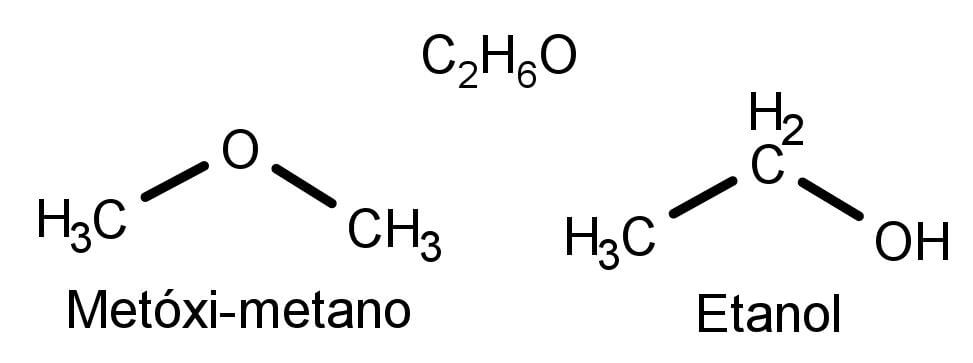
Apesar de serem parecidas, são duas moléculas diferentes: metóxi-metano e etanol. Do mesmo modo que as moléculas possuem fórmulas estruturais distintas, esses compostos possuem propriedades físicas e químicas únicas. O etanol é líquido a temperatura ambiente e usado como combustível, enquanto que o metóxi-metano é um gás e comumente aplicado como anestésico.

Quais são os tipos?
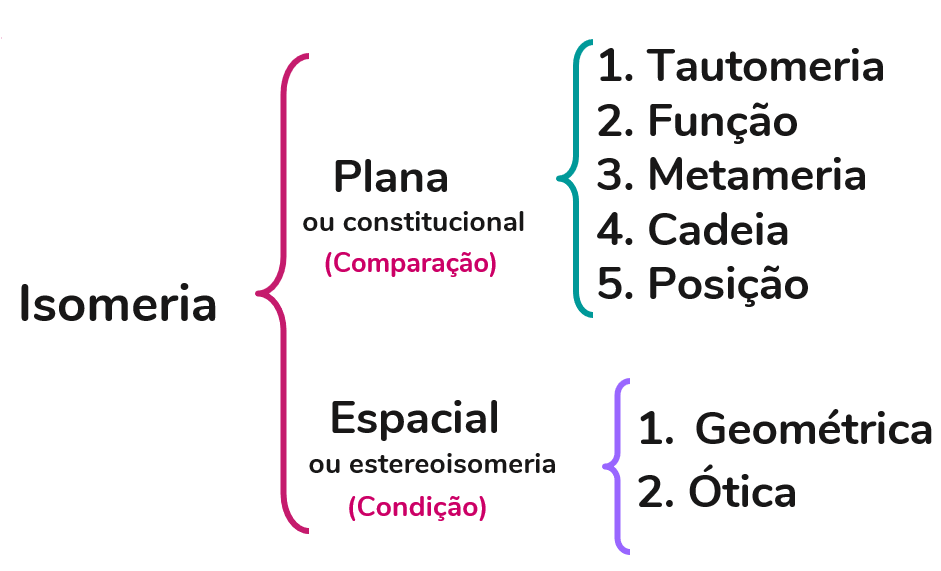
Agora que sabemos o que são isômeros, vamos entender como classificá-los. Dentro da química orgânica, a isomeria se divide em dois grandes grupos: plana e espacial.
Isomeria plana
Antes de mais nada, é importante saber que a isomeria plana é também chamada de constitucional. Ela leva em consideração a fórmula estrutural plana das moléculas, ou seja, o arranjo tridimensional dos átomos no espaço não é relevante. Ela pode ser dividida em: função, cadeia, posição e tautomeria. Assim sendo, vamos dar uma olhada em cada uma dessas divisões:
Isômeros de função
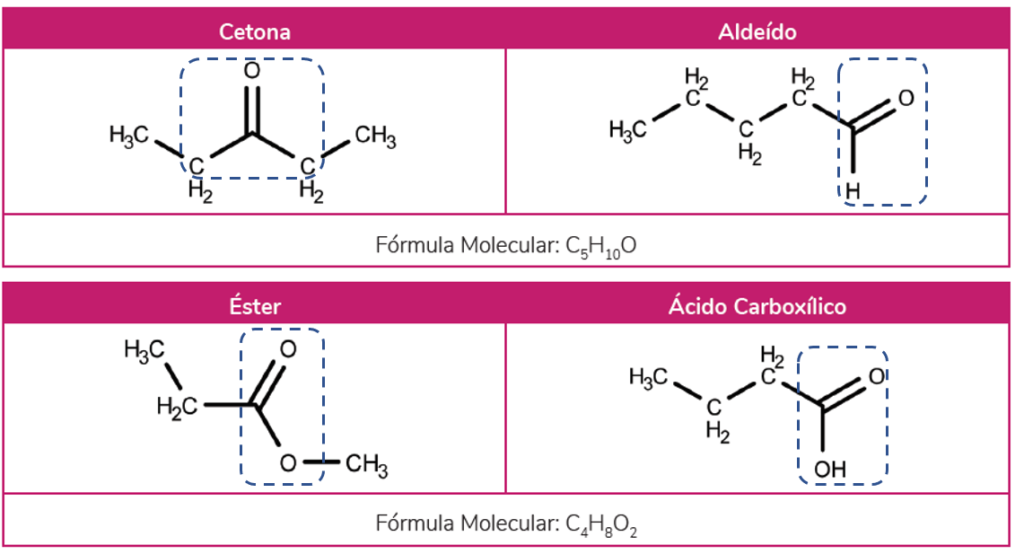
Os isômeros de função são aqueles que possuem a mesma fórmula molecular, entretanto pertencem a funções orgânicas diferentes. Se levamos em consideração, por exemplo, o metóxi-metano e o etanol, podemos dizer que eles são isômeros de função, pois o metóxi-metano é um éter, enquanto que o etanol pertence a função dos álcoois.
Desse modo, se pegamos os exemplos mais famosos, podemos citar isômeros de função entre os pares aldeído-cetona, éter-álcool e ésteres-ácidos carboxílicos.
Isômeros de cadeia
A isomeria de cadeia ocorre entre compostos com a mesma função orgânica e fórmula molecular. Assim, a diferença entre eles está na cadeia carbônica. Nesse sentido, podemos observar variações nas ramificações, grau de saturação, estrutura da cadeia e aromaticidade.
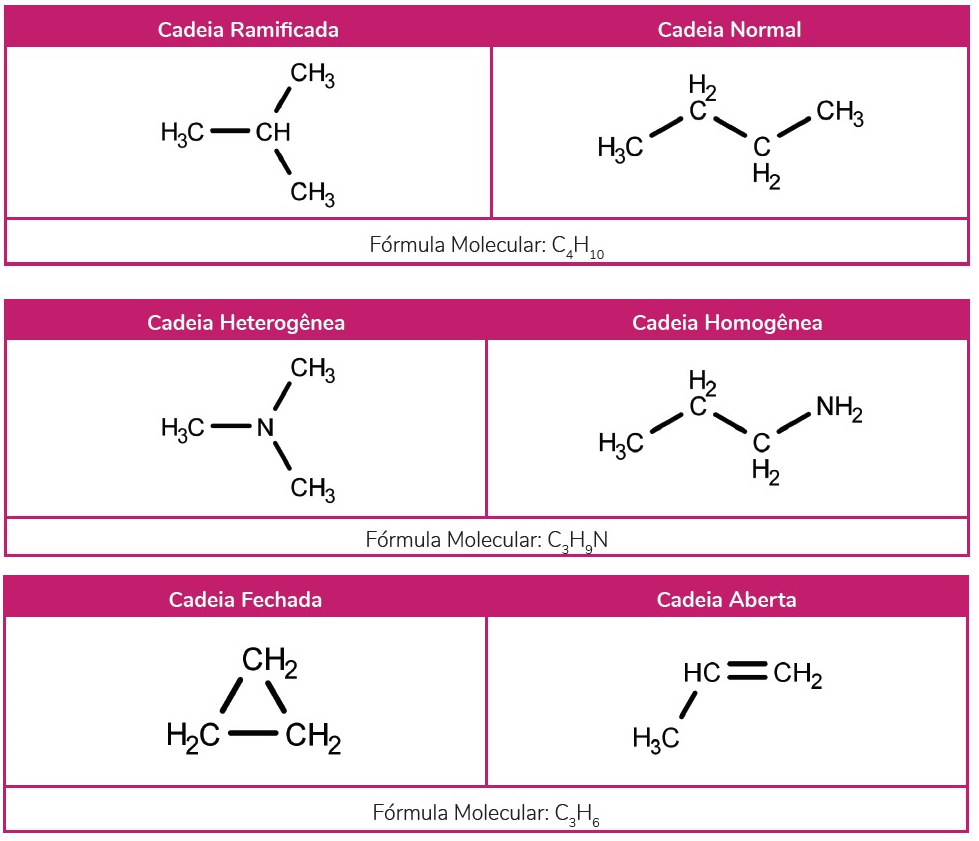
Isômeros de posição
Na isomeria de posição, como o próprio nome sugere, a diferença entre os isômeros estará na posição de algum componente da molécula. Assim, as variações podem ser no lugar da insaturação, do grupo funcional, do heteroátomo ou do substituinte. Por exemplo:
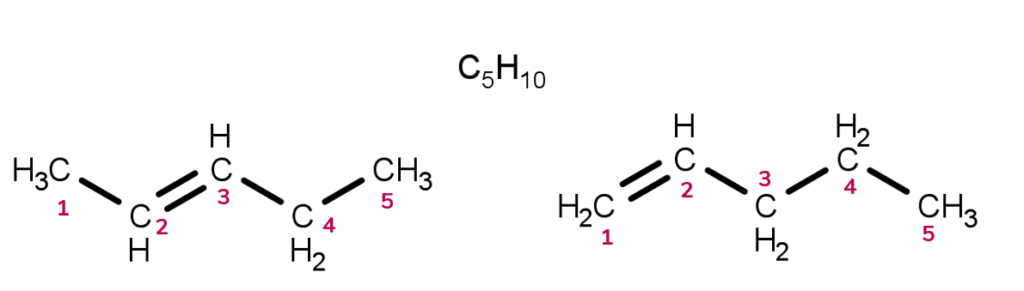
As duas moléculas mostradas a cima possuem fórmula molecular C5H10. A diferença entre elas está na posição da insaturação. Na molécula da esquerda, temos a dupla ligação entre o carbonos 2-3. Em contrapartida, no composto a direita, a ligação π ocorre entre os carbonos 1-2. Sendo assim, esses alcenos são isômeros de posição.
Tautomeria
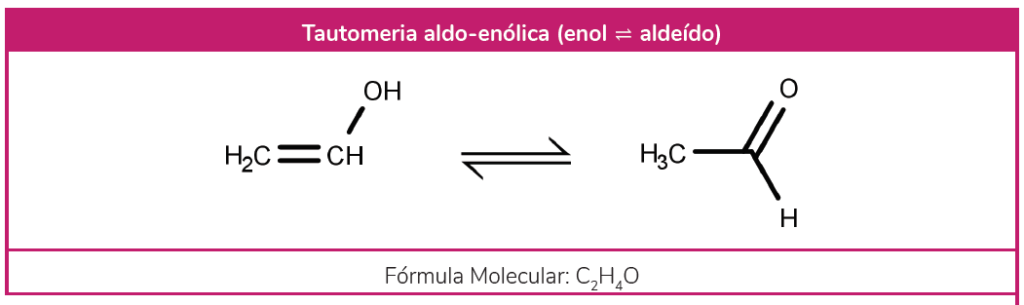
A tautomeria é também chamada constitucional. Ela é um tipo de isomeria dinâmica, ou seja, ocorre um equilíbrio químico entre compostos de funções orgânicas diferentes. Repare que, apesar de estarmos falando em variação de função, a tautomeria não é uma isomeria de função. Em resumo, aqui temos uma molécula que, em solução aquosa, estabelece um equilíbrio que altera a sua função orgânica. Existem apenas dois grupos que sofrem tautomeria: aldo-enólica e ceto-enólica.
Nessa primeira, existe um equilíbrio entre um enol – molécula cujo grupo funcional -OH está ligado a um carbono sp² –, e um aldeído. Esse equilíbrio acontece porque a ligação dupla dos enóis é instável, devido à eletronegatividade do oxigênio.
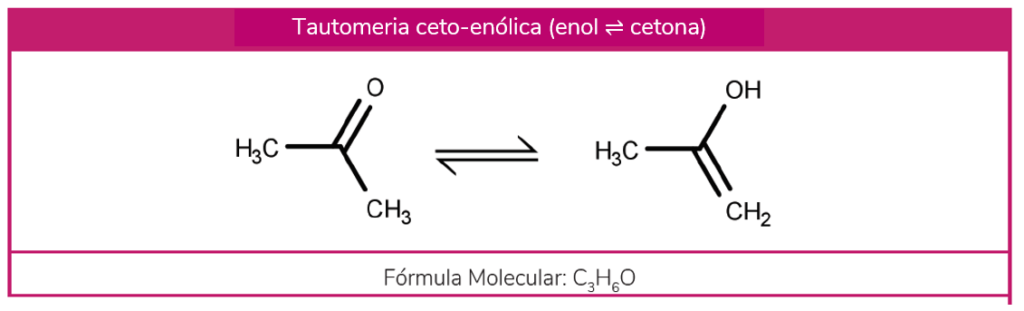
Na tautomeria Ceto-enólica, uma cetona pode ser convertida a um enol quando o oxigênio da cetona captura um hidrogênio de um carbono. Assim, a ligação C-H se desfaz e uma ligação O-H é formada. Ocorre a transferência da dupla do grupo C=O para a ligação C-C.
Isomeria espacial
Algumas moléculas orgânicas possuem a mesma cadeia carbônica, o mesmo grupo funcional, insaturação na mesma posição e, além disso, os mesmos substituintes, no entanto, ainda são compostos diferentes. A diferença é que, quando organizadas no espaço, seus átomos estão em posições diferentes. Esse é o caso dos isômeros espaciais! Eles podem ser classificados em isomeria geométrica e óptica.
Isômeros geométricos
A isomeria geométrica só pode ocorrer quando há ligações duplas. Para analisarmos esse tipo de isômeros, sempre olhamos exclusivamente para a porção ou porções da molécula que têm carbonos fazendo dupla ligação. Além disso, é necessário que o composto tenha as seguintes características:
- Um único carbono não pode ter dois ligantes iguais.
- Um mesmo ligante precisa aparecer em ambos os carbonos.
Para identificar isômeros geométricos, utilizamos a nomenclatura cis e trans, de acordo com sua organização no espaço. Por exemplo:
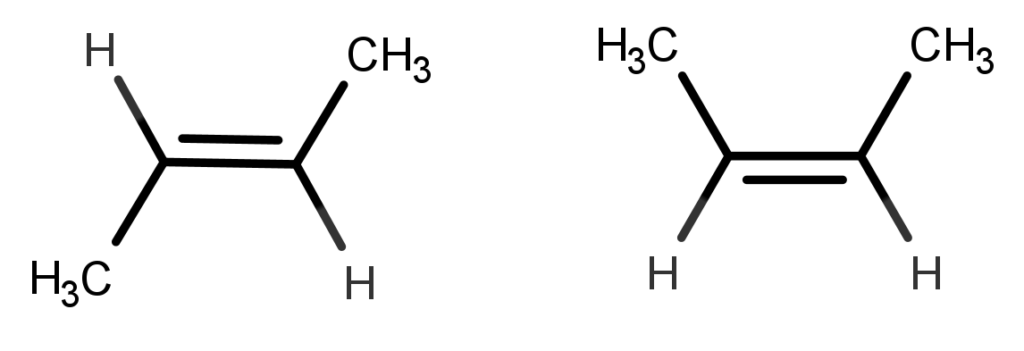
Antes de identificarmos os isômeros, é preciso conferir se eles seguem as características estabelecidas: ambas as moléculas possuem a mesma fórmula molecular, C4H8, e possuem dupla ligação. Além disso, os carbonos ligados à insaturação possuem substituintes diferentes. Agora, como identificar cis e trans?
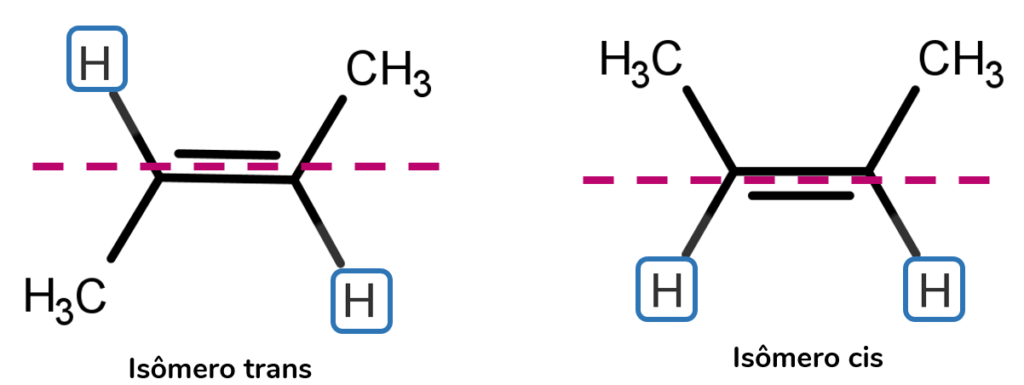
É necessário, então, traçar um plano horizontal imaginário que passe pela dupla ligação. Em seguida, analisamos a posição dos ligantes: se os ligantes iguais estão do mesmo lado, se trata do isômero cis, mas caso estejam em lados opostos, se trata do isômeros trans.
Isomeria óptica
Esse tipo de isomeria ocorre com compostos orgânicos que são a imagem especular um do outro, ou seja, esses isômeros possuem estruturas idênticas, exceto quando estão espelhadas, e por isso não são sobreponíveis. Além disso, eles recebem um nome especial: os isômeros ópticos são chamados de enantiômeros.
Dessa forma, os enantiômeros podem ser identificados através da assimetria da molécula. Os compostos assimétricos são aqueles que possuem, pelo menos, um átomo de carbono fazendo 4 ligações simples com 4 ligantes diferentes. Esse carbono é muito importante e recebe o nome de carbono quiral ou assimétrico.
Outra característica peculiar dos enantiômeros é que, como são a mesma molécula, eles possuem as mesmas propriedades físicas e químicas. Por isso, a única maneira de diferenciá-los é através de suas propriedades ópticas – ou seja, como interagem frente a luz polarizada. Observa-se, então, para qual lado o plano da luz será desviado.
Para isso, é usado um polarizador e um polarímetro contendo uma amostra de um composto orgânico para ser analisado. É possível, assim, observar três resultados:

- Amostra opticamente inativa pode indicar que aquele composto não possui carbono quiral ou que representa uma mistura racêmica, ou seja, existem quantidades iguais dos dois enantiômeros. Dessa forma, há igualdade de concentração entre dextrógiros e levógiros.
- Dextrógiro, também representado como (d), (R), (+), é toda molécula que desvia o plano da luz polarizada para a direita.
- Levógiro, também representado como (l), (S), (-), é toda molécula que desvia o plano da luz polarizada para a esquerda.
Para se preparar para o Enem ou vestibulares, conte com a plataforma Aprova Total, que oferece os melhores conteúdos e videoaulas. Conheça os cursos Extensivo Enem e Super Med!