Eletroquímica: um guia para Enem e vestibulares
Além de ser aplicada na fabricação de muitos aparelhos, como pilhas, baterias, celulares, computadores, a eletroquímica está entre os temas que caem bastante nas provas

Acessibilidade
Eletroquímica, você já ouviu falar dela? O termo é utilizado para definir um ramo da Química que estuda o fenômeno da transferência de elétrons para a transformação de energia química em energia elétrica e vice-versa.
O assunto é o segundo que mais aparece no Exame Nacional do Ensino Médio (Enem), com 8,4% de incidência na prova - dentro dela, os temas que se destacam são pilhas, cálculo DDP e potenciais de redução.
Vamos nos aprofundar nela?
NAVEGUE PELOS CONTEÚDOS
O que é eletroquímica
Agora que já sabemos o que é a eletroquímica, destacamos que baterias e pilhas são dispositivos presentes em diversas instâncias do nosso cotidiano, o que faz com que elas esteja no topo das temáticas estudadas nesse campo.
São exemplos a bateria do carro, do celular, as pilhas usadas em controles remotos e mais. Em todos os casos, a energia química converte-se em energia elétrica, sendo o fenômeno explicado pela transferência de elétrons.
Nas pilhas, esse processo é espontâneo, ou seja, é natural o fluxo de elétrons de um ponto da pilha para o outro. Quando o processo não é espontâneo chamamos de eletrólise.
O que estudar em eletroquímica?
Selecionamos alguns tópicos essenciais para estudar em eletroquímica. Veja:
Reação de oxirredução
Na Química, a transferência de elétrons é possível devido às reações de oxirredução. Sendo assim, uma reação de oxirredução trata de uma espécie que irá doar elétrons (oxidar) e outra que irá receber esses elétrons (reduzir), ou seja, tudo não se passa de transferências de elétrons.
Quer entender melhor? Então vamos observar a reação abaixo:

Essa é uma reação de oxirredução, ou seja, está ocorrendo troca de elétrons, o que faz o NOX das substâncias variar:
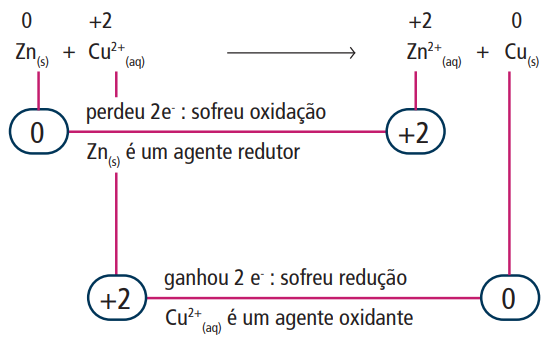
Então, analisando os números de oxidação de cada espécie nos reagentes e produtos, conseguimos ver que o zinco metálico teve que perder 2 elétrons para chegar à sua forma iônica, e que o íon de cobre teve que ganhar 2 elétrons para se transformar em cobre metálico. Sendo assim, temos:
- Oxidação
Ocorre com as espécies que perdem (doam) elétrons, resultando em um aumento do seu NOX. Também levam o nome de agente redutor, pois são responsáveis por provocar o ganho de elétrons da outra espécie química participante da reação.
- Redução
Acontece com as espécies que recebem elétrons, resultando em uma diminuição no NOX. Também levam o nome de agente oxidante, pois são responsáveis por provocar a perda dos elétrons da outra espécie química participante da reação.
Pilhas
Pilhas, também chamadas de células galvânicas, conseguem gerar energia elétrica de forma espontânea a partir da reação de oxirredução.
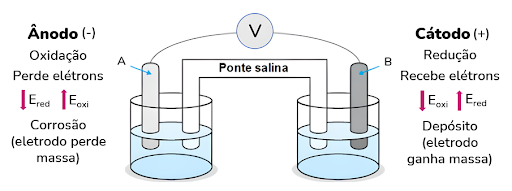
As pilha são compostas por dois eletrodos: o cátodo e o ânodo. O cátodo é o eletrodo positivo, onde ocorre a redução. Nele, ocorre a deposição no eletrodo, causando aumento de massa.
Portanto, o ânodo é o eletrodo negativo, onde ocorre a redução. Dessa forma, nele ocorre a corrosão do eletrodo, causando a perda de massa.
Atenção! Os elétrons saem do ânodo e são transferidos para o cátodo.
Cada eletrodo é imerso em uma solução salina presente em uma cuba. Além disso, ligando os meios em que esses eletrodos estão imersos, temos uma ponte salina, que serve para equilibrar as cargas em solução, transportando os íons das soluções de uma cuba para outra.
Por fim, mas não menos importante, temos um fio condutos, que liga os dois eletrodos e permite a troca de elétrons para que ocorra a reação de oxirredução.
Cálculo de DDP
Como vimos, as pilhas conseguem gerar energia elétrica a partir da reação de oxirredução. Isso ocorre pois, segundo o que aprendemos na Física, uma corrente elétrica é o fluxo de elétrons. O fluxo de elétrons só acontece na presença de uma diferença de potencial.
Assim, no caso de reações de oxirredução, normalmente se trabalha com a diferença entre os potenciais de redução das espécies envolvidas.
Potencial de redução e oxidação
O potencial-padrão de redução é a capacidade que o eletrodo apresenta de sofrer o fenômeno da redução. Quando comparamos as duas espécies passíveis de oxirredução de uma pilhas, sabemos que aquela com maior potencial-padrão de redução irá reduzir, e a com o menor irá oxidar. O valor do potencial-padrão é medido em volts (V) e é tabelado.
Da mesma maneira que existe potencial-padrão de redução, existe o de oxidação. O valor deles é o mesmo, mas com sinais opostos. O potencial de redução é a capacidade que o eletrodo apresenta de sofrer oxidação.
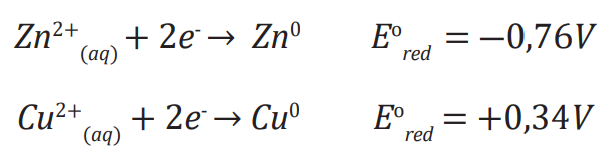
Em comparação com o zinco, o cobre tem um valor de potencial de redução maior. Então, se o cobre reduzir, o zinco precisará oxidar. Sabendo disso, a semi reação do zinco deve ser invertida.
Ao inverter a semi reação, o seu potencial terá o sinal invertido, virando um potencial de oxidação. Somando esses dois valores teremos a força eletromotriz (ou DDP) dessa pilha:
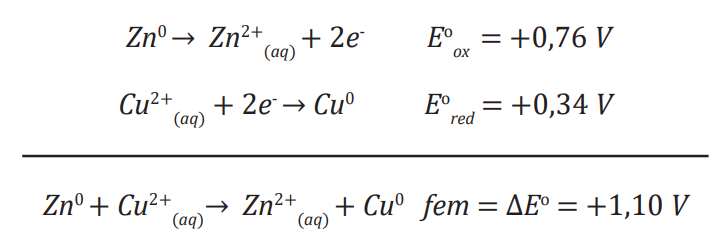
Podemos calcular a diferença de DDP como:
ΔE = Ered(espécie que reduz) – Ered(espécie que oxida)
ou
ΔE = Ered(maior) – Ered(menor)
ou
ΔE = Ered(espécie que reduz) + Eoxi(espécie que oxida)
ATENÇÃO: ΔE positivo indica um processo espontâneo.
Eletrólise
Quando estamos recarregando o smartphone, pilhas ou até mesmo nos deparamos com imagens de carros elétricos ligados na tomada, todos são fenômenos do campo da eletroquímica que envolvem a conversão de energia elétrica em energia química, por meio de reações não espontâneas.
Esses exemplos citados podem ser definidos como processo não espontâneo de descarga de íons, ou seja, a energia elétrica força o cátion a receber elétrons e o ânion a perder elétrons, para que ambos acumulem energia química.
O processo descrito é a eletrólise, reações de oxirredução não espontâneas que ocorrem com uso de energia elétrica.
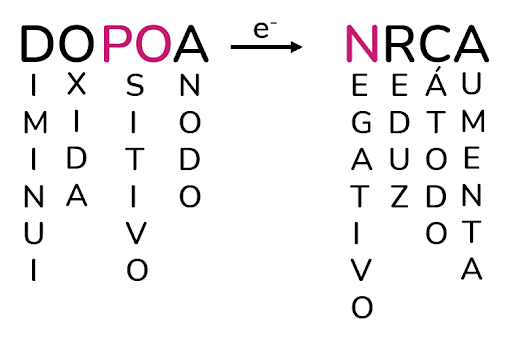
O que muda da pilha para o esquema da eletrólise?
Basicamente, o que muda entre os dois processos é que o ânodo vira o polo positivo, enquanto o cátodo vira o polo negativo. Apesar dessa mudança, o cátodo continua sendo o eletrodo no qual ocorre a redução, deposição e aumento de massa.
Da mesma forma, o ânodo continua sendo o eletrodo onde ocorre a redução, corrosão e perda de massa.
Além disso, o ΔE é NEGATIVO, pois se trata de uma reação não espontânea.
Resumindo: conceitos importantes de eletroquímica
Quer um macete muito bom para lembrar dos esquemas de uma pilha, bem como quais são os eletrodos, suas cargas e reações que ocorrem ali?
É só escrever dona porca, colocar uma flecha no meio (que representa o fluxo dos elétrons, que saem do ânodo e vão para o cátodo) e lembrar o que cada letra representa.
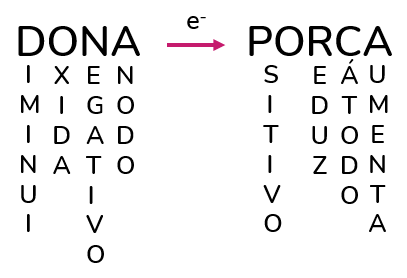
Podemos montar um esquema parecido para a eletrólise, porém mudando as cargas dos eletrodos:
Quais são as aplicações da eletroquímica?
A eletroquímica está a nossa volta: ao carregar o celular, colocar uma pilha no controle remoto, usar um carro elétrico. Assim, devido à sua importância, é um assunto muito cobrando no Enem e vestibulares.
Como a eletroquímica cai no Enem e nos vestibulares?
As questões mais comuns fornecem uma pilha e pergunta sobre seus componentes: qual é o cátodo? Qual o polo negativo? Para qual eletrodo vai o fluxo de elétrons?
Outra forma recorrente questiona se o processo é espontâneo ou não. Para isso, o enunciado fornece os potenciais de redução das substância que irão reduzir e oxidar. Fazendo o cálculo, você precisa indicar se o processo é espontâneo ou não, ou calcular o valor exato do DDP da pilha.




