Primeira lei da termodinâmica: fórmulas e aplicações
Confira aqui o que é a primeira lei da termodinâmica e aprenda a aplicá-la de forma simples nos mais diferentes tipos de transformações.

Acessibilidade
A primeira lei da termodinâmica é uma das bases da termodinâmica: a área da física que estuda as relações existentes entre energia térmica e energia mecânica.
Essa lei parte de um dos princípios mais importantes da física: o Princípio da Conservação da Energia. Segundo ele, a energia não pode ser criada nem destruída, ela apenas muda de forma.
No contexto da termodinâmica, aplicamos esse princípio aos gases ideais e relacionamos 3 grandezas referentes a eles: calor (Q), trabalho (τ) e variação de energia interna (ΔU).
A primeira lei da termodinâmica nos diz que, quando um gás ideal passa por qualquer tipo de processo (expansão, compressão, aquecimento, resfriamento, etc.), a relação entre essas 3 grandezas sempre seguirá a seguinte equação:
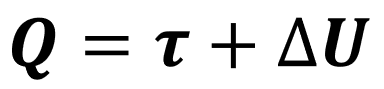
Tá, mas o que essa relação quer dizer exatamente? Antes de responder a essa pergunta, precisamos entender o que são essas grandezas e como elas variam em cada processo.
NAVEGUE PELOS CONTEÚDOS
Grandezas e sinais
Primeiramente, precisamos entender que essas grandezas estão ligadas a quantidades de energia entrando ou saindo do sistema. Além disso, existe uma convenção de sinais para cada uma delas.
Calor
Calor é como denominamos a energia térmica que flui de um corpo para outro de temperatura menor.
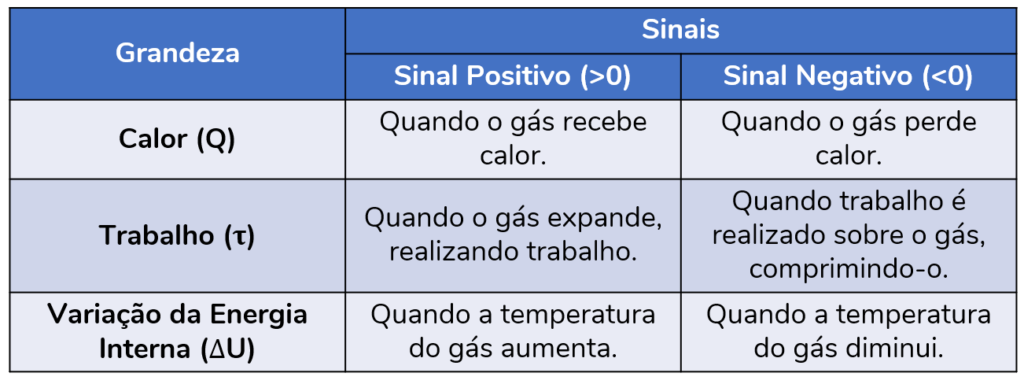
Quando um gás recebe uma quantidade de calor durante um processo, por convenção, consideramos um Q positivo (+Q). Já nos casos em que um gás perde uma quantidade de calor, consideramos um Q negativo (-Q).
Energia interna
A energia interna de um sistema é definida como a soma de todas as energias existentes nas partículas que o compõem. No caso de um gás ideal, a única energia existente é a energia cinética de agitação dessas suas partículas.
Essa energia é diretamente proporcional à temperatura do gás, ou seja, se a temperatura do gás aumenta, a sua energia interna também aumenta. Analogamente, se a temperatura do gás diminui, a sua energia interna também diminui.
Sendo assim, podemos concluir que a variação da energia interna de um gás será positiva (ΔU > 0) quando a sua temperatura aumentar e negativa (ΔU < 0) quando a sua temperatura diminuir.
Por exemplo, observe na imagem abaixo o que ocorre quando um gás preso em um recipiente é aquecido:
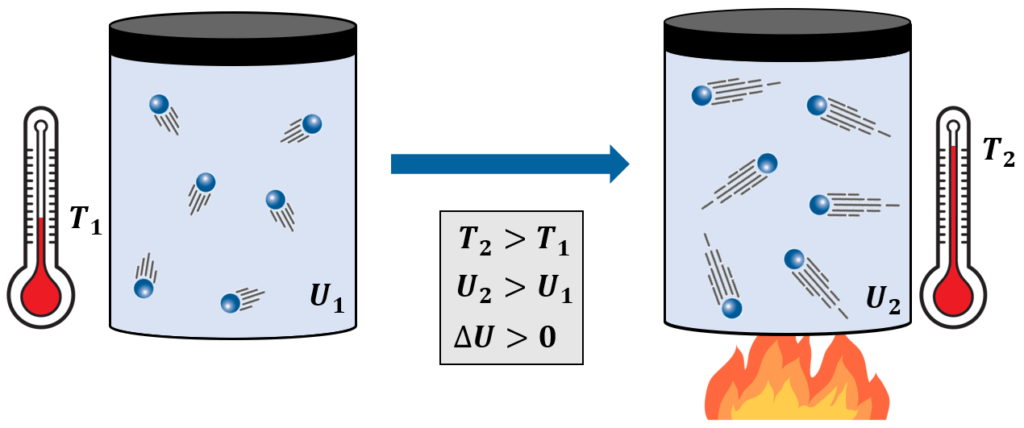
Observe que o calor recebido pela chama foi convertido na energia de agitação das partículas do gás, ou seja, foi convertido em energia interna. Isso pode ser notado macroscopicamente pelo aumento na temperatura do gás.
Seguindo a mesma lógica, o contrário também seria válido: caso o gás perdesse energia interna de alguma forma, perceberíamos uma redução em sua temperatura.
O cálculo do valor exato da energia interna varia dependendo do tipo de gás. Para gases ideais monoatômicos (gases compostos por átomos isolados), a fórmula é a seguinte:
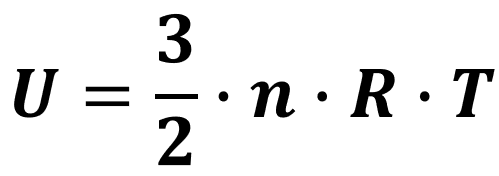
Em que n é o número de mols do gás, R é a constante universal dos gases* e T é a temperatura do gás.
*No Sistema Internacional, essa constante vale 8,31 J/(mol · K).
Trabalho
Já vimos que, quando um gás recebe calor, esse calor pode ser utilizado para incrementar a energia interna do gás. No entanto, esse calor também pode ser utilizado na expansão do gás.
Imagine um gás dentro de um recipiente com uma ou mais paredes móveis (como um êmbolo, por exemplo). Para que ele expanda (aumente de volume), ele tem que empurrar essa parede, ou seja, ele tem que realizar trabalho sobre ela:
Nesses casos, onde o gás realiza trabalho sobre algum corpo, a convenção nos diz que o trabalho τ é positivo (+τ):
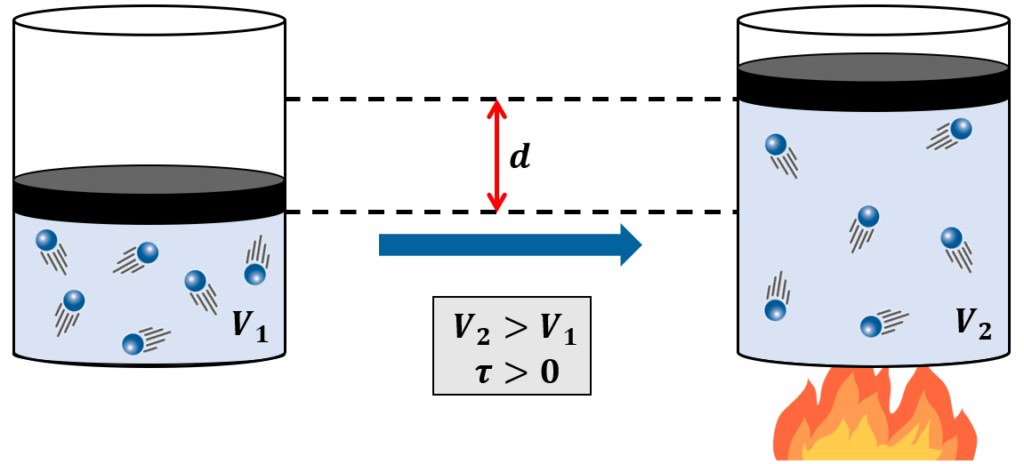
Note que, nesse caso, o calor recebido da chama foi utilizado pelo gás para realizar trabalho sobre o êmbolo, permitindo a sua expansão.
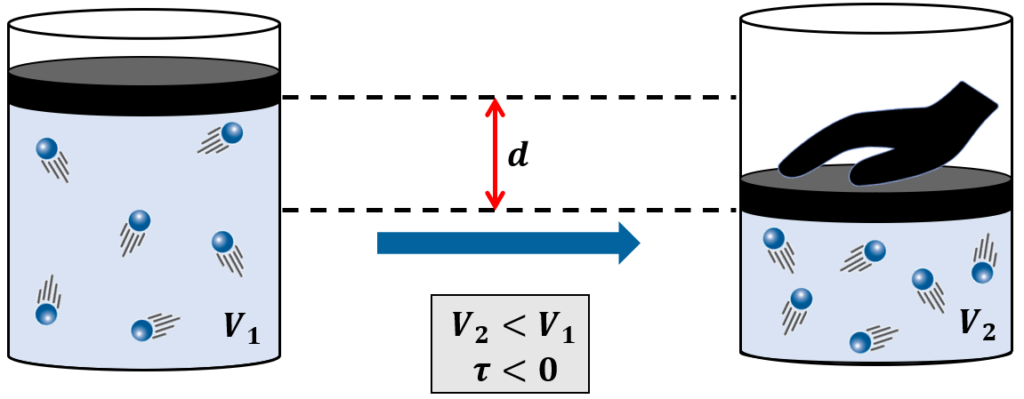
Da mesma forma, a situação inversa também pode ocorrer: um agente externo pode comprimir o gás, reduzindo o seu volume.
Nesses casos, onde trabalho é realizado sobre o gás, a convenção nos diz que o trabalho τ é negativo (-τ):
Resumo
Na tabela abaixo, temos um resumo das convenções de sinais que devem ser utilizadas na primeira lei da termodinâmica:
No caso mais geral, quando um gás recebe calor, ele pode utilizar esse calor para incrementar a sua energia interna e para realizar trabalho (as duas coisas podem acontecer ao mesmo tempo). Da mesma forma, quando um gás cede calor ao ambiente, esse calor pode ser proveniente de uma redução de sua energia interna e de um trabalho externo que é realizado sobre ele.
Agora que você já sabe como as grandezas estão relacionadas, podemos partir para o estudo de algumas transformações que recebem nomes especiais: isotérmica, isovolumétrica, adiabática, isobárica e expansão livre.
Transformação isotérmica
Chamamos de transformação isotérmica uma transformação na qual a temperatura do gás não varia durante todo o processo (ΔT = 0).
Como vimos, a energia interna depende diretamente da temperatura, logo, se a temperatura não varia, a energia interna também não varia (ΔU = 0).
Transformações termodinâmicas
Dessa maneira, podemos simplificar a primeira lei da termodinâmica da seguinte forma:
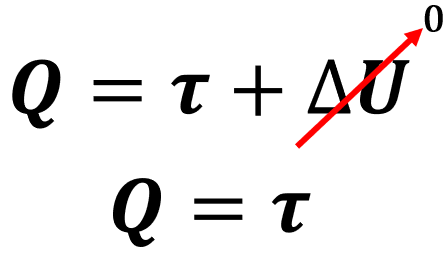
Sendo assim, se o gás recebe calor (Q > 0), essa energia é integralmente utilizada na realização de trabalho (τ > 0), permitindo a sua expansão.
Analogamente, se trabalho é exercido sobre o gás (τ < 0), comprimindo-o, ele cede para o meio externo uma quantidade de energia equivalente na forma de calor (Q < 0).
Transformação isovolumétrica
Em uma transformação isovolumétrica (também conhecida como isométrica ou isocórica), o gás mantém um volume V constante durante todo o processo (ΔV = 0), ou seja, ele não expande e nem é comprimido.
Como vimos, se o volume do gás não varia, podemos afirmar que nenhum trabalho foi realizado (τ = 0).
Portanto, podemos simplificar a primeira lei da termodinâmica da seguinte forma:
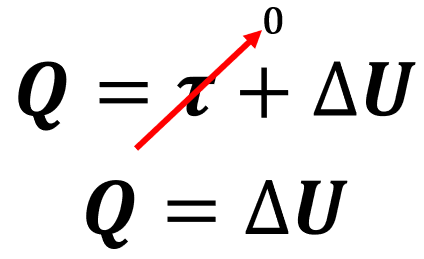
Sendo assim, se o gás recebe calor (Q > 0), a sua energia interna aumenta (ΔU > 0) em igual valor e, consequentemente, a temperatura do gás também aumenta.
Analogamente, se o gás cede calor (Q < 0) para o ambiente externo, a sua energia interna diminui (ΔU < 0) em igual valor e, consequentemente, a temperatura do gás também diminui.
Transformação adiabática
Dizemos que um sistema é adiabático quando ele está isolado de trocas de calor. Portanto, uma transformação adiabática é uma transformação em que o gás não recebe e nem cede calor para o meio externo (Q = 0).
Dessa forma, podemos simplificar a primeira lei da termodinâmica da seguinte forma:
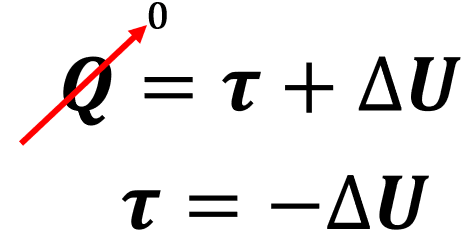
Sendo assim, se trabalho é realizado sobre o gás comprimindo-o (τ < 0), a sua energia interna aumenta (ΔU > 0) em igual valor e, consequentemente, a temperatura do gás também aumenta.
Analogamente, se o gás realiza trabalho (τ > 0) para expandir, ele o faz retirando uma parte equivalente da sua energia interna (ΔU < 0) e, consequentemente, a sua temperatura também diminui.
Transformação isobárica
Em uma transformação isobárica, a pressão P do gás se mantém constante durante todo o processo (ΔP = 0). Exclusivamente para esse tipo de transformação, podemos calcular o trabalho de duas formas simples. Ambas são equivalentes, escolha aquela que contém as grandezas que você possui:
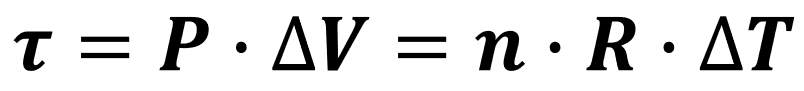
em que P é a pressão constante sobre a qual o gás está submetido, ΔV é a variação de volume que ele sofre, n é o seu número de mols, R é a constante universal dos gases e ΔT é a variação de temperatura sofrida pelo gás.
Note que, para um gás ideal a pressão constante, volume e temperatura são diretamente proporcionais.
Sendo assim, podemos afirmar que, se um o gás expande realizando trabalho (τ > 0), a sua energia interna também deve aumentar (ΔU > 0). Toda a energia utilizada para tais processos entra no sistema na forma de calor (Q > 0).
Analogamente, se trabalho é realizado sobre o gás (τ < 0), comprimindo-o, a sua energia interna também deve diminuir (ΔU < 0). Toda a energia resultante de tais processos sai do sistema na forma de calor (Q < 0).
Expansão livre
Por fim, temos a expansão livre. Ela ocorre quando um gás tem total liberdade para expandir (quando ele não precisa realizar trabalho para fazê-lo) e, ao mesmo tempo, ele não troca calor com a sua vizinhança.
Como não há realização de trabalho (τ = 0) e nem trocas de calor (Q = 0), podemos afirmar que a energia interna do gás também não varia (ΔU = 0) e que a sua temperatura mantém-se constante durante o processo.
Resumo
Na tabela abaixo, você encontrará um resumo de tudo o que discutimos sobre transformações termodinâmicas:





