Pureza dos reagentes: aprenda a calcular na estequiometria
Cálculo Estequiométrico é um conteúdo bastante cobrado nos mais diversos vestibulares do Brasil. Neste post, mostramos como trabalhar com a pureza dos reagentes

Acessibilidade
O cálculo estequiométrico, ou estequiometria, estuda as relações de massa, mol e partículas entre reagentes e produtos nas reações químicas.
Por isso, como as reações químicas acontecem em proporções definidas, é fácil trabalhar com o cálculo estequiométrico normal, o qual não considera a pureza dos reagentes.
Com isso, a pureza de um reagente é o quanto daquela amostra realmente corresponde ao composto que vai reagir.
Por exemplo, em uma massa de 100g de Cobre com 100% de pureza, toda a massa corresponde ao cobre puro. Mas se a pureza for de 98%, temos 98 g de cobre, e 2 g de impurezas que não vão reagir para formar os produtos esperados.
NAVEGUE PELOS CONTEÚDOS
Estequiometria passo a passo
Para entendermos a estequiometria, precisamos, antes de tudo, interpretar o que a questão está pedindo.
De maneira geral, podemos seguir esses passos:
1. Escreva a equação química balanceada.
2. Identifique as proporções entre reagentes e produtos.
3. Converta as unidades para mol, massa ou volume, conforme pede a questão.
4. Multiplique o reagente em questão pelo seu grau de pureza, para determinar a quantidade que efetivamente vai reagir.
5. Monte uma regra de três com as informações necessárias, onde a incógnita é o que a questão está pedindo.
Leia também:
Estequiometria: o que é, cálculo e dicas
Cálculo estequiométrico e rendimento das reações
Estequiometria: reagente limitante e em excesso
Cálculo estequiométrico com pureza dos reagentes
Na prática, os reagentes não são 100% puros. Na verdade, é praticamente impossível isolar completamente um composto, mesmo com técnicas de separação modernas e refinadas.
Por isso, o rendimento das reações nunca é 100%. Como os reagentes são impuros, sempre haverá menos produto formado do que o esperado. Assim, no cálculo estequiométrico, é comum que as provas considerem esse percentual de impurezas dos reagentes ao tratar das reações químicas.
Considere uma barra de cobre com pureza 100%:

Dessa forma, podemos afirmar que 100% da massa dessa barra é devida aos átomos de cobre. Porém, na realidade, o cenário poderia ser este:

Assim, somente 98% da massa dessa barra corresponde a átomos de cobre, enquanto os outros 2% correspondem a outras substâncias indeterminadas, que não participam da reação para formar o produto desejado.
Caso 1: Quantidade de produto a partir de um reagente impuro
Sabendo que uma amostra de Cu com 98% de pureza reage com O2 para formar CuO, determine a massa de Óxido de Cobre obtida a partir de 13 g de Cu.
2 Cu + O2 → 2 CuO
Sabemos também que dispomos de 13 g de Cu, dos quais somente 98% correspondem a átomos de cobre, que participam da reação. Dessa forma, precisamos determinar a massa real de cobre:
13 g ----------- 100%
x g ----------- 98%
x = 12,7 g de Cu
Assim, somente 12,7 g de Cu podem reagir com O2 para formar CuO. Nessa reação, nas proporções estequiométricas ideais, sabemos pelas massas molares que 127 g de Cu formam 159 g de CuO. Com uma regra de três, matamos o problema:
127 g Cu ---------- 159 g de CuO
12,7 g de Cu ---------- x g de CuO
x = 15,9 g de CuO
Então, formamos 15,9 g de CuO a partir de 13 g de Cu com 98% de pureza.
Caso 2: Cálculo estequiométrico da pureza de um reagente
Para obtenção de cobre metálico, pode-se reduzir o CuO, produzindo Cu° e O2. A partir de 20 g de CuO, obteve-se 15 g de Cu. Determine a pureza do óxido de cobre.
2 CuO → 2 Cu° + O2
Desse modo, sabemos que 159 g de CuO podem produzir 127 g de Cu, pelas suas massas molares e coeficientes estequiométricos.
Podemos determinar qual deveria ser a massa de CuO necessária para obtermos as 15 g de Cu.
159 g de CuO ------------ 127 g de Cu
x g de CuO ------------ 15 g de Cu
x = 18,8 g de Cu
Dessa forma, para se produzir 15 g de Cu, precisaríamos de 18,8 g de CuO com 100% de pureza. Entretanto, a amostra inicial era de 20 g. Isso significa que temos 20 g - 18,8 g = 1,2 g de impurezas.
Determinando a pureza:
20 g de Cu ---------- 100%
18,8 g de Cu ---------- x %
x = 81,5% de pureza.
Assim, o reagente inicial, CuO, era somente 94% puro.
Caso 3: Cálculo do rendimento de uma reação com impurezas
20 g de Óxido de Cobre com 98% de pureza reagem para formar 10 g de Cu. Determine o rendimento da reação.
2 CuO → 2 Cu° + O2
Dessa forma, precisamos determinar qual a massa real de CuO na amostra, retirando-se os 2% de impureza:
20 g de CuO ------- 100%
x g de CuO ------- 98%
x = 19,6 g de CuO.
Assim, somente 19,6 g de CuO podem reagir. Pelas proporções estequiométricas, sabemos que 159 g de CuO formam 127 g de Cu.
159 g de CuO --------- 127 g de Cu
19,6 g de CuO --------- x g de Cu
x = 15,6 g de Cu
Portanto, para um rendimento de 100%, os 19,6 g precisariam formar 15,6 g de Cu. Porém, foram formados somente 10 g. Agora, podemos calcular o rendimento:
15,6 g de Cu ---------- 100% de rendimento
10 g de Cu ---------- x % de rendimento
x = 64,1% de rendimento
Assim, o rendimento total da reação foi de 64,1%.
Caso 4: Estequiometria com pureza + rendimento
Uma massa de 40 g de CuO com 98% de pureza é reduzida para formar Cu com 90% de rendimento. Determine a massa de Cu obtida.
2 CuO → 2 Cu° + O2
Enfim, podemos seguir os seguintes passos:
1. Determinar a massa real do reagente impuro;
2. Determinar a massa de Cu formada para o rendimento máximo (100%);
3. Determinar a massa real de Cu obtida com o rendimento fornecido (90%).
Dessa forma, 40 g com 98% de pureza corresponde a 39,2 g de CuO.
40 g x 0,98 = 39,2 g.
Sabemos que 159 g de CuO reduzem para formar 127 g de Cu, nas condições estequiométricas perfeitas. Assim, calculamos a massa de Cu obtida para o rendimento total:
159 g de CuO ----------- 127 g de Cu
39,2 g de CuO ----------- x g de Cu
x = 31,3, g de Cu
Todavia, 31,3 g são para o rendimento total de 100%. Por isso, precisamos determinar qual foi a massa real obtida, com o rendimento fornecido de 90%.
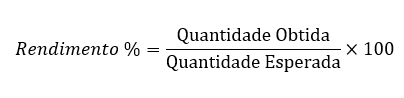
Então, com uma manipulação, obtemos:

Assim, a quantidade obtida é
31,3 g de Cu.0,90 = 28,2 g de Cu.




