Coloides: definição, exemplos e propriedades
Um coloide é um tipo de mistura heterogênea, onde as partículas dispersas no meio dispersante tem um diâmetro na faixa de 1 a 1000 nm. Conheça os principais exemplos de coloides e suas propriedades

Acessibilidade
Um coloide é um tipo de mistura heterogênea, onde as partículas dispersas no meio dispersante tem um diâmetro na faixa de 1 a 1000 nm.
Os coloides podem apresentar como dispersante um meio sólido, líquido ou gasoso. Alguns exemplos de coloides são o sangue, o leite, a maionese, o isopor, as nuvens, a gelatina... e muitos outros! Vamos falar mais a respeito de sua classificação, propriedades e exemplos.



NAVEGUE PELOS CONTEÚDOS
Constituição dos coloides
Quando estudamos sobre coloides, nos deparamos com termos novos: disperso e dispersante.
Disperso: como o próprio nome diz, é aquilo que esta disperso no meio (partículas). O disperso pode ser visto como o equivalente ao soluto das soluções.
Dispersante: é o que está em maior quantidade e envolve o disperso. O dispersante equivale ao solvente das soluções.
Propriedades dos coloides
Tamanho de partícula
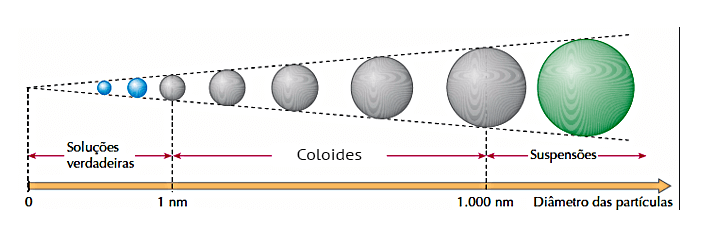
Partículas dispersas que possuem um diâmetro maior que 1 nm, mas menor que 1000 nm, entram na definição de coloides. Essas partículas são pequenas e leves o suficiente para que não se depositem, mas ainda sim grandes demais para classificarem o sistema como homogêneo.
Um coloide, a olho nu, apresenta somente uma fase, o que nos leva a acreditar que é uma mistura homogênea. Porém, ao observar a mistura em um ultramicroscópio, percebe-se a presença de mais de uma fase, o que classifica a mistura como heterogênea.
Um coloide, em nível macroscópico, parece homogêneo. Em nível microscópico (ou nanoscópico), ele é heterogêneo.
Já uma partícula com um diâmetro menor que 1 nm está na faixa de tamanho dos átomos, moléculas e íons. Quando esse tipo de partícula está dissolvida em um meio, a mistura é homogênea, ou seja, uma solução (cloreto de sódio em água e açúcar em água são exemplos de soluções).
Uma mistura com partículas de diâmetro maior que 1000 nm caracteriza uma suspensão. Nesse caso as partículas são grandes e sedimentam no fundo do recipiente após um certo tempo, sendo assim, uma suspensão é uma mistura heterogênea (água e areia é um exemplo de suspensão).
Efeito Tyndall
Embora as partículas de uma dispersão coloidal sejam pequenas a ponto do meio parecer homogêneo, elas são grandes o suficiente para espalharem a luz visível. A consequência disso é a maioria dos coloides terem aparência opaca e turva. Por exemplo, as micelas de gordura e macromoléculas de proteína presentes no leite são capazes de refletir a luz incidente, o que explica sua cor branca.
Esse efeito da dispersão da luz incidente pelas partículas do meio é conhecido como efeito Tyndall, uma propriedade dos coloides. Soluções verdadeiramente homogêneas não apresentam essa propriedade.

O efeito Tyndall é perceptível quando um feixe de luz é incidido em um coloide, como mostrado abaixo. Na imagem vemos que o líquido do primeiro frasco não apresenta o efeito Tyndall, diferente daquele presente no segundo frasco.

É o efeito Tyndall que explica porque os motoristas devem deixar a luz dos faróis do carro baixa em dias de neblina: ela é um coloide do tipo aerossol (partículas dispersas em um gás), que reflete a luz incidida e dificulta mais ainda visualização da estrada.

Movimento Browniano
O movimento browniano é o movimento aleatório que ocorre com as partículas dispersas num fluido (líquido ou gás), devido a constante colisão com as moléculas do dispersante. Veja este fenômeno na animação abaixo:

Essa constante movimentação do disperso no fluido é um dos motivos para que as partículas não sedimentem.
Classificação e exemplos
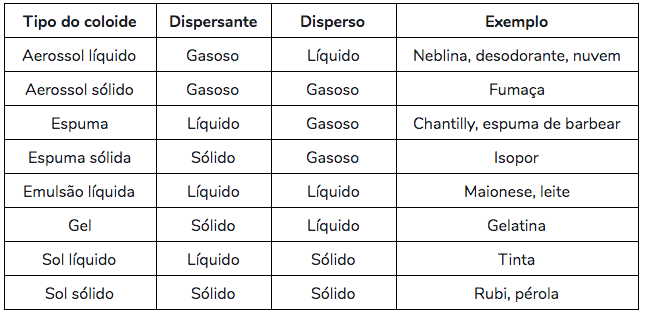
Assim como as soluções, as dispersões coloidais podem estar no estado sólido, líquido ou gasoso. A tabela abaixo apresenta os tipos de coloides e seus principais exemplos.
Emulsão: um coloide que requer algo a mais
Uma emulsão é uma dispersão coloidal envolvendo fases que naturalmente não se misturam, como por exemplo óleo em água. Sendo assim, para que a mistura fique estável, é necessária a presença de um agente emulsificante.
O agente emulsificante contém moléculas anfifílicas, as quais são capazes de "unir" os opostos, já que têm em sua estrutura molecular uma parte hidrofóbica (interage com a fase oleosa) e outra hidrofílica (interage com a fase aquosa). As estruturas formadas são chamadas de micelas.
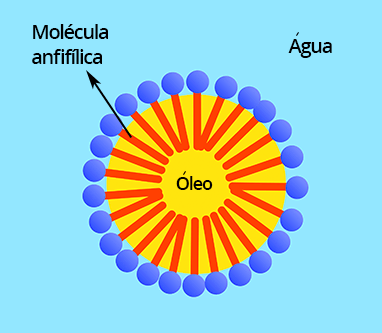

Um exemplo de emulsão é a maionese! As receitas de maionese levam como ingredientes vinagre, óleo vegetal e gemas de ovo. O vinagre caracteriza a fase aquosa e o óleo vegetal a fase oleosa. Sendo assim, o ingrediente que sobrou para estabilizar esse sistema e possibilitar a existência da emulsão é a gema de ovo! A gema do ovo contém um estabilizante natural, a lecitina. A lecitina é uma mistura de fosfolipídios, triglicerídeos, glicolipídeos e carboidratos.
Métodos de separação de coloides
Devido ao tamanho pequeno das partículas dispersas nos coloides, não é possível separar as fases da mistura por métodos tradicionais de filtração ou por decantação.
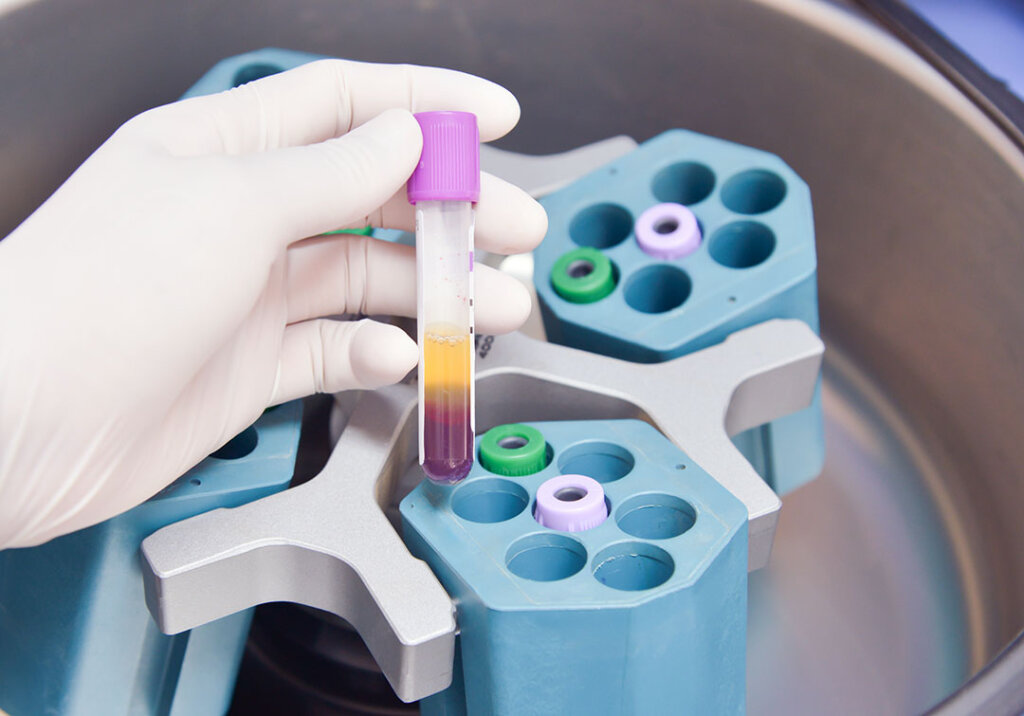
A filtração dessas partículas pode ser feita através de métodos de ultrafiltração, onde utilizam-se como filtros membranas semipermeáveis, ou por meio da centrifugação, onde utiliza-se uma centrífuga para que haja a separação dos componentes via sedimentação.
Coloides na biologia
Sangue: solução, coloide ou suspensão?
Devido sua complexidade, o sangue pode ser classificado de diferentes formas, sendo que todas elas são coexistentes.
O sangue é uma solução pois nele existem pequenas substâncias dissolvidas, como por exemplo o cloreto de sódio. Também trata-se de uma solução coloidal, já que nele encontram-se diversas macromoléculas de dimensões coloidais, como proteínas e polissacarídeos. Além disso, pode ser classificado como uma dispersão coloidal, mais especificamente como uma emulsão, já que existem gotículas de gorduras dispersas.
E não acaba por aí, pois o sangue também é uma suspensão! Ele pode ser classificado dessa maneira devido a existência de partículas sólidas de dimensões maiores, como as hemácias, leucócitos e plaquetas. Nesse caso, se uma amostra de sangue for deixada em repouso por um certo tempo, haverá uma separação de fases devido ação da gravidade.

